题目内容
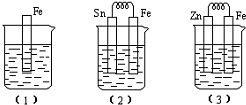
2. 某电解池装置如图所示:
某电解池装置如图所示:(1)外电源的负极是Y(填“X”或“Y”)
(2)阳极室中发生的反应依次为2Cl--2e-=Cl2↑,NaHCO3+Cl2=NaCl+CO2+HClO,
(3)若外电路转移0.02mol电子,则膜两侧溶液质量变化差△m左-△m右=0.46g.
分析 (1)由图可知,左池反应生成氯气,右池生成氢气,据此得出X应为阳极;
(2)阳极氯离子放电生成氯气,氯气与碳酸氢钠反应生成二氧化碳;
(3)外电路转移0.02mol电子,氯离子恰好放电完毕,据此解答即可.
解答 解:(1)由图可知,左池反应生成氯气,右池生成氢气,据此得出X应为阳极,Y为阴极,即Y连接外电源的负极,故答案为:Y;
(2)阳极室中,氯离子失去电子生成氯气,然后生成的氯气与碳酸氢钠反应生成二氧化碳气体,化学反应方程式分别为:2Cl--2e-=Cl2↑,NaHCO3+Cl2=NaCl+CO2+HClO,故答案为:2Cl--2e-=Cl2↑,NaHCO3+Cl2=NaCl+CO2+HClO;
(3)0.2mol/LNaCl溶液100mL,物质的量=0.02mol,由于2Cl--2e-=Cl2↑,此反应中转移2mol电子,故若外电路转移0.02mol电子时,氯离子恰好放电完毕,氯气与碳酸氢钠反应:NaHCO3+Cl2=NaCl+CO2+HClO,右池生成氢气0.01mol,故有0.02mol钠离子移向右池,即此时左池溶液质量减少:0.44g+0.02mol×23g/mol=0.90g,右池中质量增加为:0.46-0.02g=0.44g,故膜两侧溶液质量变化差△m左-△m右=0.90g-0.44g=0.46g,故答案为:0.46.
点评 本题主要考查的是电解池工作原理,涉及知识点:电解方程式书写、氧化还原反应转移电子数守恒、溶液电中性原则等,有一定难度.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.向Fe(NO3)2溶液中加入少量稀盐酸,可能出现的现象是( )
| A. | 溶液由黄色变为浅绿色 | B. | 溶液由浅绿色变为黄色 | ||
| C. | 溶液由浅绿色变为血红色 | D. | 有气体产生 |
13.下列提纯物质(括号中为杂质)的试剂和分离方法正确的是( )
| 选项 | 被提纯的物质(杂质) | 除杂试剂 | 分离方法 |
| A | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| B | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
| C | 乙醇(乙酸) | 新制生石灰 | 蒸馏 |
| D | 甲苯(苯酚) | 浓溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
10.某溶液中只可能含有下列离子中的几种(不考虑溶液中含的较少的H+和OH-)Na+、NH4+、SO42-、CO32-、NO3-.取200mL该溶液,分为等体积的二份分别做下列实验.实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL.实验2:第二份先加入足量的盐酸,无现象,再加足量的BaCl2溶液,得固体2.33克.下列说法正确的是( )
| A. | 该溶液中不一定含有Na+ | |
| B. | 该溶液中肯定含有NH4+、SO42-、CO32-、NO3- | |
| C. | 该溶液中一定不含NO3- | |
| D. | 该溶液中一定含Na+,且c(Na+)≥0.1 mol/L |
17.羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得.下列有关说法正确的是( )
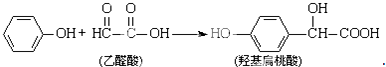

| A. | 该反应是取代反应 | |
| B. | 乙醛酸与H2在热的镍催化下反应生成乙二醇 | |
| C. | 1mol羟基扁桃酸能与3mol NaOH反应 | |
| D. | 1mol羟基扁桃酸能与1mol NaHCO3反应 |
7.NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 1mol•L-1的FeCl3 溶液中Fe3+个数少于NA | |
| B. | 46gNO2 中含有N原子数为NA | |
| C. | 17g羟基(-OH)与17gOH-所含电子数均为10 NA | |
| D. | 8.4g Fe与标准状况下3.36LCl2充分反应,转移电子数为0.3 NA,生成FeCl2 |
14.下列离子方程式正确的是( )
| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+ $\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| B. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+3Ag↓+H2O | |
| C. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- | |
| D. | 苯酚钠溶于醋酸溶液:C6H5O-+CH3COOH→C6H5OH+CH3COO- |
12.糖类、油脂、蛋白质都是人类必需的基本营养物质,关于它们的说法正确的是( )
| A. | 麦芽糖及其水解产物均能发生银镜反应 | |
| B. | 棉花、纸、醋酸纤维的主要成分都是纤维素 | |
| C. | 淀粉、牛油、蛋白质都是天然高分子化合物 | |
| D. | 变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应 |