题目内容
7.下列各组物质中化学键类型不相同的是( )| A. | NaCl和HNO3 | B. | H2O和NH3 | C. | CaCl2和NaCl | D. | H2S和Na2S |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,酸、部分盐、部分碱、非金属氧化物、非金属多原子单质中都含有共价键,部分碱、部分盐和金属氧化物中含有离子键.
解答 解:A.NaCl中只含离子键、HNO3中只含共价键,所以化学键类型不同,故A正确;
B.H2O和NH3都只存在共价键,所以化学键类型相同,故B错误;
C.CaCl2中只含离子键,NaCl中只含离子键,所以化学键类型相同,故C错误;
D.H2S中只含共价键、Na2S中只含离子键,所以化学键类型不同,故D正确;
故选AD.
点评 本题考查了离子键和共价键的判断,明确离子键和共价键的区别即可解答,属于基础题,题目难度不大.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
17.下列离子方程式中,不正确的是( )
| A. | 向FeCl2溶液中通入,2Fe2++Cl2=2Fe3++2Cl- | |
| B. | FeCl3溶液跟过量氨水,Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+ | |
| C. | 碳酸氢钙溶液跟稀硝酸,Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ | |
| D. | 钠与水的反应,2Na+2H2O=2Na++2OH-+H2↑ |
18.已知I2易溶于有机溶剂中,现欲从碘水中萃取出I2,下列溶剂不能作为萃取剂的是( )
| A. | 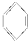 | B. | CCl4 | C. | 酒精 | D. | 氯仿 |
15.分子式C8H8O2的有机物,含有一个苯环,且能发生水解反应,则该有机物苯环上的一溴代物有( )
| A. | 9种 | B. | 16种 | C. | 19种 | D. | 25种 |
2.下列是对一些分子中共价键的描述,其中不正确的是( )
| A. | HCl分子中的共价键是由H原子的1s轨道和Cl原子未成对电子的3p轨道形成的s-pσ键 | |
| B. | 石墨晶体中碳原子的杂化轨道类型为sp2,碳原子间只存在sp2-sp2σ键 | |
| C. | H2O分子中的共价键是由O原子的sp3杂化轨道和H原子的s轨道形成的s-sp3σ键 | |
| D. | N2分子中的共价键是由2个N原子各自用3个p轨道形成的3个p-pπ键 |
12.某甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸、和水等,某同学为了检验产品中的苯甲酸和硫酸,做了如下实验.(已知H2SO3:K1=1.3×10-2 K2=6.3×10-8,苯甲酸:Ka=6.46×10-5,碳酸;K1=4.30×10-7 K2=5.61×10-11)限选试剂:0.1 mol•L-1BaCl2溶液,0.1 mol•L-1Ba(OH)2溶液,1.0 mol•L-1Na2CO3溶液,1.0mol•L-1NaHCO3溶液,1 mol•L-1HCl溶液,1 mol•L-1Na2SO3溶液,1 mol•L-1NaHSO3溶液.
| 实验操作 | 实验现象及结论 |
| ①取粗产品于试管中,加入1.0 mol•L-1Na2CO3溶液,酯溶解度减小振荡分层,用分液漏斗分液,得到水层加入0.1 mol•L-1BaCl2溶液 | 白色沉淀生成,说明含有硫酸 |
| ②取①反应后的溶液于试管中,加入1 mol•L-1HCl溶液 | 出现白色晶体,证明含有苯甲酸 |
3.把Cl2通入含22g NaBr的溶液中,反应后加热,烘干得到固体13.1g,则此固体成分为( )
| A. | NaCl | B. | NaCl和NaBr | C. | NaBr | D. | 无法确定 |
1.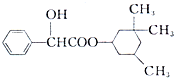 环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物持的叙述中,正确的是( )
环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物持的叙述中,正确的是( )
 环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物持的叙述中,正确的是( )
环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物持的叙述中,正确的是( )| A. | 该物质属于芳香烃 | |
| B. | 该有机物难溶于水 | |
| C. | 分子式为C17H23 | |
| D. | 1mol该物质最多可与2molNaOH发生反应 |