��Ŀ����
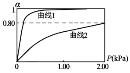
����Ŀ��2019��ŵ������ѧ������������ӵ�ؿ�������λ��ѧ�ҡ�һ������ӵ�صĽṹ��ͼ��ʾ����ط�ӦʽΪ LixC6 + Li1-xCoO2![]() C6+LiCoO2(x<1)������˵����ȷ���ǣ� ��
C6+LiCoO2(x<1)������˵����ȷ���ǣ� ��
A.���ʱ a �������Դ�ĸ���
B.�ŵ�ʱLi+�ڵ��������b����a��Ǩ��
C.���ʱ��ת��0.02 mol���ӣ�ʯī�缫������0.14 g
D.�÷Ͼɵ�ؽ������ŵ紦�������������ʯī������
���𰸡�B
��������
�ŵ�ʱ�ķ�ӦΪLi1-xCoO2+LixC6�TLiCoO2+C6��LixC6(�ɿ��ɵ���﮺�̼)Ϊ������Li�Ļ��ϼ����߱��Li+����Li1-xCoO2Ϊ������CoԪ�صĻ��ϼ۽��ͣ�CoԪ�ص�ԭ�ӵõ����ӣ�ԭ����и�������������Ӧ������������ԭ��Ӧ��������Ƿŵ������̡�
A. �ŵ�ʱa��(Li1-xCoO2)Ϊ�����õ����ӣ����������̣�a��Ӧʧȥ���������ص���������������ӵ�Դ��������A����
B. �ŵ�ʱ��ʯī��(b��)LixC6ʧȥ����Ϊ��������Li1-xCoO2(a��)Ϊ��������ԭ�����������������������Li+�ڵ��������b����a��Ǩ�ƣ�B��ȷ��
C. ���ʱ��ʯī(C6)�缫���LixC6���缫��ӦʽΪ��xLi++C6+xe-�TLixC6����ʯī(C6)�缫���ص��������Dzμӷ�Ӧ������ӵ����������ݹ�ϵʽ��xLi+ �� xe- ��֪����ת��0.02mole-����Ӧ�������Ϊ0.02molLi+��������0.14g��C����
D. �ŵ�ʱ����ص�������ӦΪ��Li1-xCoO2+xLi++xe-�TLiCoO2 ��������ӦΪLixC6-xe-�TxLi++C6���÷Ͼɵ�ؽ������ŵ紦�������������LiCoO2�����գ�D����
��ΪB��

����Ŀ����Ȳ��������ϩ��ҵ�е���Ҫ���Ʒ�Ӧ��������һ��Ӧ���Խ���ϩ��Ʒ�е���Ȳ�������ͣ��Ա��������ϩ�ۺϴ������ж�����ҵ�ϳ�Ϊ̼��������̡�
��֪��I. ![]()
![]() ��
��
II. ![]()
![]() ��
��
�ش��������⣺
(1)��֪���ֻ�ѧ���ļ��������ʾ��
��ѧ�� |
|
|
|
|
����/ | 436 | 413.4 | 615 | 812 |
![]() =____________
=____________![]() ��
��
(2)400Kʱ�����ܱ������н������ʵ�����![]() ��
��![]() ��ϣ������ʵ��Ĵ������з�Ӧ������
��ϣ������ʵ��Ĵ������з�Ӧ������![]() ���ﵽƽ��ʱ���
���ﵽƽ��ʱ���![]() ����ƽ��ʱ
����ƽ��ʱ![]() _____
_____![]() ��
��
(3)��ǰ���о�������Ȳ��![]() �Ŵر�������ⷴӦ�IJ���������ͼ��ʾ������������
�Ŵر�������ⷴӦ�IJ���������ͼ��ʾ������������![]() �����ϵ�������*��ע��
�����ϵ�������*��ע��

�Ʋ���ϩ��![]() �����ϵ�����Ϊ__________(��������������������)���̡�ͼ���������������(���)E��=______
�����ϵ�����Ϊ__________(��������������������)���̡�ͼ���������������(���)E��=______![]() ���ò���Ļ�ѧ����ʽΪ___________��
���ò���Ļ�ѧ����ʽΪ___________��
(4)![]() ʱ���������Ϊ1:2��
ʱ���������Ϊ1:2��![]() ��
��![]() ��������ܱ������У��������������Ӧ����ʼ��ϵ��ѹǿΪ
��������ܱ������У��������������Ӧ����ʼ��ϵ��ѹǿΪ![]() ��ʵ����
��ʵ����![]() �ķ�ѹ
�ķ�ѹ![]() �뷴Ӧʱ��
�뷴Ӧʱ��![]() �Ĺ�ϵ��ͼ��ʾ��
�Ĺ�ϵ��ͼ��ʾ��
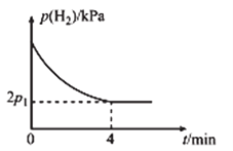
��![]() ʱ��
ʱ��![]() �ڣ�ƽ����Ӧ����
�ڣ�ƽ����Ӧ����![]() ______
______![]() (�ú�
(�ú�![]() �Ĵ���ʽ��ʾ����ͬ)��
�Ĵ���ʽ��ʾ����ͬ)��
��![]() ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��
ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��![]() _____
_____![]() (
(![]() Ϊ�Է�ѹ��ʾ��ƽ�ⳣ������ѹ=��ѹ�����ʵ�������)��
Ϊ�Է�ѹ��ʾ��ƽ�ⳣ������ѹ=��ѹ�����ʵ�������)��
��![]() ʱ��
ʱ��![]() �ڣ�
�ڣ�![]() �ļ�С��______(����������������������)
�ļ�С��______(����������������������) ![]() ��
��![]() �ļ�С��������Ϊ__________��
�ļ�С��������Ϊ__________��
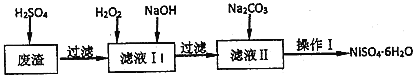
����Ŀ��NiSO46H2O��һ����ɫ������ˮ�ľ��壬�㷺���ڻ�ѧ������������صȣ����ɵ�Ʒ�Һ(�������⣬������Cu��Fe��Cr������)Ϊԭ�ϻ�á�����������ͼ��
��֪�� 25��ʱ�����ֽ�������������ܶȻ���������ȫ������pH��Χ���±���ʾ��
Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
Ksp | 8.0��10-16 | 4.0��10-38 | 6.0��10-31 | 6.5��10-18 |
��ȫ����pH | ��9.6 | ��3.2 | ��5.6 | ��8.4 |
ע��NiCO3��һ�ֲ�����ˮ������ǿ��ij�����
��ش��������⣺
(1)���д�ʩ���У�������߷��������ʵ���________��
A.���߷�Ӧ�¶� B.����ѹǿ C.�ڷ�Ӧ�����в��Ͻ���
(2)����ҺI�м���6%��H2O2����������__________(�����ӷ���ʽ��ʾ)������NaOH����pH�ķ�Χ��_________��Ϊ�˳�ȥ��Һ�е�_________���ӡ�
(3)����Ni2+����ȫ������ʵ�鷽����_________________��