题目内容
【题目】乙炔加氢是乙烯工业中的重要精制反应,利用这一反应可以将乙烯产品中的乙炔含量降低,以避免后续乙烯聚合催化剂的中毒,工业上称为碳二加氢过程。
已知:I. ![]()
![]() ;
;
II. ![]()
![]() ;
;
回答下列问题:
(1)已知几种化学键的键能如表所示:
化学键 |
|
|
|
|
键能/ | 436 | 413.4 | 615 | 812 |
![]() =____________
=____________![]() 。
。
(2)400K时,在密闭容器中将等物质的量的![]() 和
和![]() 混合,采用适当的催化剂进行反应,生成
混合,采用适当的催化剂进行反应,生成![]() ,达到平衡时测得
,达到平衡时测得![]() ,则平衡时
,则平衡时![]() _____
_____![]() 。
。
(3)据前人研究发现乙炔在![]() 团簇表面催化加氢反应的部分历程如图所示,其中吸附在
团簇表面催化加氢反应的部分历程如图所示,其中吸附在![]() 表面上的物种用*标注。
表面上的物种用*标注。

推测乙烯在![]() 表面上的吸附为__________(填“放热”或“吸热”)过程。图中历程中最大能垒(活化能)E正=______
表面上的吸附为__________(填“放热”或“吸热”)过程。图中历程中最大能垒(活化能)E正=______![]() ,该步骤的化学方程式为___________。
,该步骤的化学方程式为___________。
(4)![]() 时,将体积比为1:2的
时,将体积比为1:2的![]() 和
和![]() 充入刚性密闭容器中,加入催化剂发生反应Ⅱ,起始体系总压强为
充入刚性密闭容器中,加入催化剂发生反应Ⅱ,起始体系总压强为![]() ,实验测得
,实验测得![]() 的分压
的分压![]() 与反应时间
与反应时间![]() 的关系如图所示:
的关系如图所示:

①![]() 时,
时,![]() 内,平均反应速率
内,平均反应速率![]() ______
______![]() (用含
(用含![]() 的代数式表示,下同)。
的代数式表示,下同)。
②![]() 时,该反应的化学平衡常数
时,该反应的化学平衡常数![]() _____
_____![]() (
(![]() 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
③![]() 时,
时,![]() 内,
内,![]() 的减小量______(填“>”“<”或“=”)
的减小量______(填“>”“<”或“=”) ![]() 内
内![]() 的减小量,理由为__________。
的减小量,理由为__________。
【答案】![]() 3 放热 22.59
3 放热 22.59 ![]()
![]()
![]() > 反应物浓度减小,反应速率减慢
> 反应物浓度减小,反应速率减慢
【解析】
(1)根据![]() 反应物的键能总和-生成物的键能总和进行计算;
反应物的键能总和-生成物的键能总和进行计算;
(2)结合盖斯定律,判断Ⅱ、Ⅰ与![]() 的关系,从而计算其平衡常数,进而计算氢气的浓度;
的关系,从而计算其平衡常数,进而计算氢气的浓度;
(3)根据图像分析;
(4)根据已知信息列出三段式进行计算。
(1)根据![]() 反应物的键能总和-生成物的键能总和,可知
反应物的键能总和-生成物的键能总和,可知![]() ,故答案为:-193.8;
,故答案为:-193.8;
(2)结合盖斯定律,Ⅱ-Ⅰ得![]() ,平衡常数
,平衡常数![]() ,平衡时测得
,平衡时测得![]() ,则
,则![]() ,故答案为:3;
,故答案为:3;
(3)由图可知,![]() 为
为![]() ,
,![]() 的过程为乙烯的脱附,需要吸收
的过程为乙烯的脱附,需要吸收![]() 的能量,则反之
的能量,则反之![]() 的过程为乙烯的吸附,放出
的过程为乙烯的吸附,放出![]() 的能量;
的能量;![]() 过程中活化能最大,为
过程中活化能最大,为![]() ,该步骤的化学方程式为
,该步骤的化学方程式为![]() ,故答案为:放热;22.59;
,故答案为:放热;22.59;![]() ;
;
(4)①反应开始时,![]() ,
,![]() ,可列出三段式:
,可列出三段式:
![]()
 ,则
,则![]() ,解得
,解得![]() ,故
,故![]() 内,平均反应速率
内,平均反应速率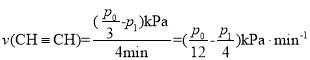 ,故答案为:
,故答案为:![]() ;
;
②该反应的化学平衡常数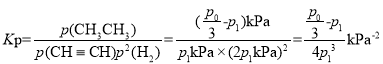 ,故答案为:
,故答案为:![]() ;
;
③因为随反应进行,反应物浓度减小,反应速率减慢,故答案为:>;反应物浓度减小,反应速率减慢。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案【题目】根据下列实验操作和现象得出的结论正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 甲烷与 | 产物能使湿润的蓝色石蕊试纸变红 | 氯代烷在水中电离出 |
B | 向填有硫酸处理的 | 固体由橙色变为绿色 | 乙醇具有氧化性 |
C | 向 | 产生黑色沉淀 | 硫酸的酸性弱于 |
D | 将金属钠在燃烧匙中点燃,迅速伸入集满 | 产生大量白烟,瓶内有黑色颗粒产生 |
|
A.AB.BC.CD.D