题目内容
【题目】元素镍(Ni)、锰(Mn)及其化合物常用作工业生产的催化剂。已知Ni(OH)2(蓝绿色)、Mn(OH)2(紫色)均难溶于水,Ksp[Ni(OH)2]=6×1018,Ksp[Mn(OH)2]=2×1013,回答下列问题:
(1)某溶液中含有浓度较大的Ni2+和Mn2+,向其中滴加NaOH溶液,当Ni2+恰好沉淀完全(恰好完全沉淀时Ni2+浓度等于1.0×105mol·L1)时,溶液中的c(H+)=_______mol/L,此时溶液中c(Mn2+)=_______mol/L(提示:![]() )。
)。
(2)血红蛋白(Hb)与O2和CO存在如下平衡:Hb(aq)+O2(g)![]() HbO2(aq)K1,Hb(aq)+CO(g)
HbO2(aq)K1,Hb(aq)+CO(g)![]() HbCO(aq)K2,正常体温下血红蛋白与两种气体的结合度(α)(注:α
HbCO(aq)K2,正常体温下血红蛋白与两种气体的结合度(α)(注:α![]() =),随两气体平衡分压的变化关系如下图所示:
=),随两气体平衡分压的变化关系如下图所示:
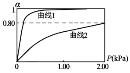
①若平衡常数K1远小于K2,则上图中曲线1代表的气体是_______;利用图中所给数据计算曲线2所代表平衡的平衡常数_______(用气体的平衡分压代替气体的平衡浓度)
②CO和Ni能发生反应生成四羰基镍:Ni+4CO![]() Ni(CO)4(四羰基镍),已知四羰基镍在温度高的条件下易分解,则该反应的正反应是_______(填“放热反应”或“吸热反应”),四羰基镍进入人体血液后更容易释放出金属镍,从而使人镍中毒,分析其中的原因_______。
Ni(CO)4(四羰基镍),已知四羰基镍在温度高的条件下易分解,则该反应的正反应是_______(填“放热反应”或“吸热反应”),四羰基镍进入人体血液后更容易释放出金属镍,从而使人镍中毒,分析其中的原因_______。
(3)已知Ni(OH)3难溶于水,它可由Ni(OH)2与NaClO溶液反应得到,试写出该反应的离子方程式_______。
【答案】1.3×10-8 0.34或0.33都可得分 CO 2.00kPa-1 放热反应 Ni(CO)4进入血液后,CO会与血红蛋白结合,使平衡Ni+4CO![]() Ni(CO)4逆向移动,从而使人体内金属镍增多 2Ni(OH)2+ClO-+H2O=2Ni(OH)3+Cl-
Ni(CO)4逆向移动,从而使人体内金属镍增多 2Ni(OH)2+ClO-+H2O=2Ni(OH)3+Cl-
【解析】
(1)根据Ksp的表达式进行相关计算;(1)根据平衡移动原理分析并计算平衡常数;(3)根据电子守恒及电荷守恒书写并配平离子方程式。
(1)Ni2+恰好完全完全沉淀时c(Ni2+)=1×10-5,根据Ksp[Ni(OH)2]=c(Ni2+)×c2(OH-)=6×10-18,解得c(OH-)=7.7×10-7,则c(H+)=![]() (mol/L);Ksp[Mn(OH)2]=c(Mn2+)×c2(OH-)=c(Mn2+)×(7.7×10-7)2=2×10-13,解得c(Mn2+)=0.34(mol/L)[注:由Ni(OH)2的Ksp表达式求得c2(OH-),将该值整体代入Mn(OH)2的Ksp表达式中可求得c(Mn2+)=0.33(mol/L)也可得分],故答案为:1.3×10-8;0.34或0.33;
(mol/L);Ksp[Mn(OH)2]=c(Mn2+)×c2(OH-)=c(Mn2+)×(7.7×10-7)2=2×10-13,解得c(Mn2+)=0.34(mol/L)[注:由Ni(OH)2的Ksp表达式求得c2(OH-),将该值整体代入Mn(OH)2的Ksp表达式中可求得c(Mn2+)=0.33(mol/L)也可得分],故答案为:1.3×10-8;0.34或0.33;
(2)①因为血红蛋白与CO反应的平衡常数大,说明CO更容易与血红蛋白结合,因此在同一条件下CO与血红蛋白的结合度(其实就是血红蛋白的转化率)大于O2与血红蛋白的结合度,故曲线1代表的气体是CO。设Hb(aq)的初始浓度为c,当氧气的平衡分压p(O2)=2.00kPa时,c(HbO2)平衡=0.80c;c(Hb)平衡=0.20c;故Hb(aq)+O2(g)![]() HbO2(aq)在正常体温下的平衡常数K=
HbO2(aq)在正常体温下的平衡常数K=![]() ,故答案为:CO ;2.00kPa-1;
,故答案为:CO ;2.00kPa-1;
②高温下Ni(CO)4易分解,说明升温会使反应Ni+4CO![]() Ni(CO)4逆向移动,故逆反应为吸热反应,则正反应为放热反应;由于血红蛋白与CO结合能力非常强,故Ni(CO)4进入血液后,血红蛋白结合CO,使Ni+4CO
Ni(CO)4逆向移动,故逆反应为吸热反应,则正反应为放热反应;由于血红蛋白与CO结合能力非常强,故Ni(CO)4进入血液后,血红蛋白结合CO,使Ni+4CO![]() Ni(CO)4逆向移动,金属镍在血液中沉积,故答案为:放热反应;Ni(CO)4进入血液后,CO会与血红蛋白结合,使平衡Ni+4CO
Ni(CO)4逆向移动,金属镍在血液中沉积,故答案为:放热反应;Ni(CO)4进入血液后,CO会与血红蛋白结合,使平衡Ni+4CO![]() Ni(CO)4逆向移动,从而使人体内金属镍增多;
Ni(CO)4逆向移动,从而使人体内金属镍增多;
(3)NaClO具有强氧化性,将+2价Ni氧化为+3价,根据得失电子守恒和电荷守恒,离子方程式为:2Ni(OH)2+ClO-+H2O=2Ni(OH)3+Cl-,故答案为:2Ni(OH)2+ClO-+H2O=2Ni(OH)3+Cl-。