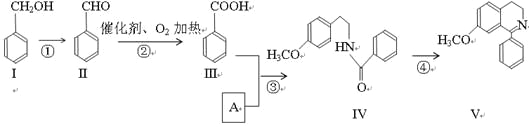
��Ŀ����
����Ŀ��(1)�����������ʣ�ά����A��ά����C����Ԫ�ء���Ԫ�ء����ۡ���֬����ѡ����ȷ��������Ӧ�Ŀո��
������ȱ��ij��ά���ػ�����Ѫ��������ά������________��
������ȱ��ij����Ԫ�ػᷢ��ƶѪ��������Ԫ����________��
�ۼ���Ϊ�����ṩ�����������ṩ����֬�����������________��
(2)��������Ҫ��ѭ����������������Դ����ԭ��Ŀǰ���õķ�����________��________��________�����ַ����������ס�
(3)�����ڳ�ʪ�Ŀ�����ܿ�ͱ���ʴ��ԭ�����ڸ����ı����γ���һ��������Һ�ı�Ĥ���������������������̼��������С��ԭ��أ���д��������������Ҫ�ĵ缫��Ӧʽ������________����________��
(4)��ʳ�е���������������ת���������Ƕ������գ�һ���������������ڱ������ֽ⣬�ͷų���������д���÷�Ӧ�Ļ�ѧ����ʽ��________�������Ǿ��л�ԭ�ԣ�����������Һ����������Ӧ������������ҺʱӦ��2%ϡ��ˮ��μ���1 mL2%AgNO3��Һ�У���________Ϊֹ���ټ���1 mL10%��������Һ����ˮԡ����3��5min���۲쵽���������ɣ���д����������Ӧ�Ļ�ѧ����ʽ��________��
���𰸡�ά����C ��Ԫ�� ��֬ �������� �ѷ� ���� O2+4e-+2H2O��4OH�� Fe��2e-��Fe2+ C6H12O6+6O2��6CO2+6H2O ��������ij���ǡ���ܽ� CH2OH(CHOH)4CHO+2Ag(NH3)2OH![]() CH2OH(CHOH)4COONH4+H2O+2Ag��+3NH3
CH2OH(CHOH)4COONH4+H2O+2Ag��+3NH3
��������
(1)������ȱ��ά����C������Ѫ����������ά������ά����C��
������ȱ����Ԫ�ػᷢ��ƶѪ����������Ԫ������Ԫ�أ�
����֬�Ǽ���Ϊ�����ṩ�����������ṩ����֬��������ʣ���������������֬��
(2)Ŀǰ�������������õķ��������������ѷʷ��ͷ��շ������ַ����������ף�
(3)�����е�����̼������ˮ����ԭ��أ����Ը����ܷ����绯ѧ��ʴ���ڸ�ԭ����У�����������̼��������������̼�������õ��ӷ�����ԭ��Ӧ���缫��ӦʽΪ��O2+4e-+2H2O��4OH-���ڸ������ϣ���ʧ���ӷ���������Ӧ���缫��ӦʽΪ��Fe-2e-��Fe2+��
(4)�����������ڷ��������������ɶ�����̼��ˮ����Ӧ�Ļ�ѧ����ʽΪ��C6H12O6+6O2��6CO2+6H2O������������ҺʱӦ��ϡ��ˮ��μ���AgNO3��Һ�У�����������ij���ǡ���ܽ�Ϊֹ����������������Һ��ˮԡ���������·���������ԭ��Ӧ��CH2OH(CHOH)4CHO+2Ag(NH3)2OH![]() CH2OH(CHOH)4COONH4+H2O+2Ag��+3NH3��
CH2OH(CHOH)4COONH4+H2O+2Ag��+3NH3��

����Ŀ����������ʵ�����������ó��Ľ�����ȷ����( )
ѡ�� | ʵ����� | ʵ������ | ���� |
A | ������ | ������ʹʪ�����ɫʯ����ֽ��� | �ȴ�����ˮ�е���� |
B | ���������ᴦ���� | �����ɳ�ɫ��Ϊ��ɫ | �Ҵ����������� |
C | �� | ������ɫ���� | ������������� |
D | ����������ȼ�ճ��е�ȼ��Ѹ�����뼯�� | �����������̣�ƿ���к�ɫ�������� |
|
A.AB.BC.CD.D
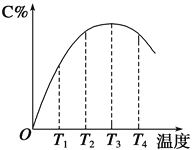
����Ŀ����֪2SO2��g��+O2��g��2SO3��g����H=��197kJmol��1������ͬ��ʽ��ס��Һͱ�3����ͬ������Ͷ�뷴Ӧ��ұ��ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й����������
���� | �� | �� | �� |
��Ӧ��Ͷ���� | 2molSO2��1molO2 | 1molSO2��0.5molO2 | 2molSO3 |
ƽ�ⳣ�� | K1 | K2 | K3 |
��Ӧ�������仯 | �ų�akJ | �ų�bkJ | ����ckJ |
�����ܶ� | ��1 | ��2 | ��3 |
��Ӧ��ת���� | ��1 | ��2 | ��3 |
�����йع�ϵʽ��ȷ���ǣ� ��
A. K1=K3��K2 B. ��1=��3����2 C. ��2+��3��1 D. 2b+c��197