题目内容
9.下表是元素周期表的一部分,有关说法正确的是 ( )| 族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | VⅠA | VⅡA |
| 2 | a | b | c | ||||
| 3 | d | e | f | g | h | i |
| A. | a、b、e、f四种元素的原子半径:e>f>b>a | |
| B. | h、i两种元素阴离子的还原性:h>i | |
| C. | a、g两种元素氢化物的稳定性:g>a | |
| D. | d、e、f三种元素最高价氧化物对应的水化物的碱性依次增强 |
分析 由元素在周期表中位置,可知a为C、b为N、c为O、d为Na、e为Mg、f为Al、g为Si、h为S、i为Cl.
A.同周期自左而右原子半径减小、同主族自上而下原子半径增大;
B.同周期自左而右非金属性增强,非金属性越强,阴离子还原性越弱;
C.同主族自上而下元素非金属性减弱,非金属性越强,氢化物越稳定;
D.金属性越强,最高价氧化物对应水化物的碱性越强.
解答 解:由元素在周期表中位置,可知a为C、b为N、c为O、d为Na、e为Mg、f为Al、g为Si、h为S、i为Cl.
A.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:e>f>a>b,故A错误;
B.同周期自左而右非金属性增强,非金属性越强,阴离子还原性越弱,故阴离子的还原性:h>i,故B正确;
C.同主族自上而下元素非金属性减弱,非金属性越强,氢化物越稳定,故氢化物稳定性:甲烷>硅烷,故C错误;
D.金属性越强Na>Mg>Al,最高价氧化物对应水化物的碱性越强,故碱性:氢氧化钠>氢氧化镁>氢氧化铝,故D错误,
故选B.
点评 本题考查元素周期表与元素周期律,难度不大,侧重对元素周期律的考查,注意对基础知识的理解掌握.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
7.2SO2(g)+O2(g)$?_{△}^{V_{2}O_{5}}$2SO3(g)是制备硫酸的重要反应.下列叙述正确的是( )
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大反应体系的压强,反应速率一定增大 | |
| C. | 一段时间内生成1 mol O2(g)同时生成1 mol SO3(g),说明反应达到平衡 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$ |
17.X、Y、Z三种元素的原子,其核外电子排布分别为:X最外层有1个电子,Y有3个电子层,最外层电子数比次外层的少3,Z的最外层电子数是次外层的3倍.由这三种元素组成的化合物的化学式不可能是( )
| A. | XYZ2 | B. | XYZ3 | C. | X2YZ2 | D. | X3YZ3 |
18.由FeO、Fe2O3和Fe3O4组成的混合物,测得其铁元素与氧元素的质量比为21:8,则混合物中FeO、Fe2O3和Fe3O4的物质的量之比可能是( )
| A. | 1:2:1 | B. | 2:1:1 | C. | 2:1:2 | D. | 2:2:5 |
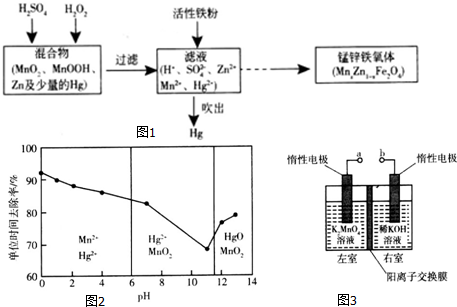
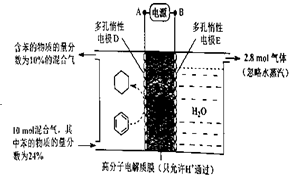


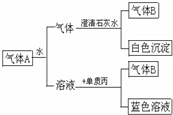 如图所示将红热固体单质甲,投入显黄色的溶液乙中,剧烈反应产生混合气体A,A在常温下不与空气反应,根据下列变化填空:
如图所示将红热固体单质甲,投入显黄色的溶液乙中,剧烈反应产生混合气体A,A在常温下不与空气反应,根据下列变化填空: