题目内容
14.将Mg、Al组成的混合物共0.2mol溶于100mL 3mol/LH2SO4溶液中,再滴加1mol/LNaOH 溶液,在滴加NaOH溶液的过程中,沉淀的质量m随NaOH溶液体积V的变化如图所示: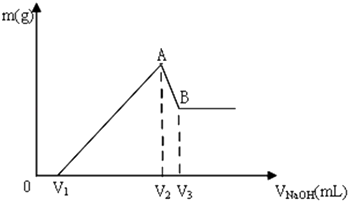
(1)A点沉淀的成分是Mg(OH)2、Al(OH)3(用化学式表示).
(2)A点沉淀的总物质的量n=0.2mol.
(3)V2=600mL.
(4)若混合物仍为0.2mol,其中Mg的物质的量分数为a,用100mL 3mol/LH2SO4溶液溶解此混合物后,再加入360mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3,则满足此条件的a的取值范围为0.5≤a<1.
分析 镁铝的混合物溶于盐酸溶液中,发生反应生成氯化镁和氯化铝,先反应后的溶液中滴入氢氧化钠溶液,在氢氧化钠体积小于V1时,氢氧化钠与没有反应的盐酸反应,故0~V1mL时,不产生沉淀,氢氧化钠体积为V1mL~V2mL,氯化镁和氯化铝与开始氢氧化钠反应生成氢氧化镁和氢氧化铝,在A点时沉淀达到最大量;氢氧化钠体积为V2mL~V3mL氢氧化铝和氢氧化钠反应,生成偏铝酸钠,当氢氧化钠体积为V2mL,镁离子和铝离子恰好沉淀,溶液中阳离子为Na+,阴离子为Cl-,即溶液中的溶质为NaCl,n(Na+)=n(Cl-),其中Na+来自NaOH,Cl-来自HCl,故当氢氧化钠体积为V2mL,n(NaOH)=n(HCl),据此解答(1)(2)(3);
(4)若混合物仍为0.2mol,其中镁的物质的量分数为a,用100mL 3mol/LH2SO4溶液溶解后,再加入360mL 1mol•L-1氢氧化钠溶液,所得溶液无Al(OH)3沉淀,证明生成的氢氧化铝全部和氢氧化钠反应,由上述分析知:v1=300ml,再加入360mL 1mol•L-1氢氧化钠溶液,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,求得:Al(OH)3最大取值0.06mol,即0<n(Al)≤0.06mol,n(Mg)+n(Al)=0.2mol,据此判断镁的物质的量范围及a的范围.
解答 解:镁铝的混合物溶于盐酸溶液中,发生反应生成氯化镁和氯化铝,先反应后的溶液中滴入氢氧化钠溶液,在氢氧化钠体积小于V1时,氢氧化钠与没有反应的盐酸反应,故0~V1mL时,不产生沉淀,氢氧化钠体积为V1mL~V2mL,氯化镁和氯化铝与开始氢氧化钠反应生成氢氧化镁和氢氧化铝,在A点时沉淀达到最大量;氢氧化钠体积为V2mL~V3mL氢氧化铝和氢氧化钠反应,生成偏铝酸钠,当氢氧化钠体积为V2mL,镁离子和铝离子恰好沉淀,溶液中阳离子为Na+,阴离子为Cl-,即溶液中的溶质为NaCl,n(Na+)=n(Cl-),其中Na+来自NaOH,Cl-来自HCl,
(1)根据分析可知,A点的沉淀为:Mg(OH)2、Al(OH)3,故答案为:Mg(OH)2、Al(OH)3;
(2)镁和铝的物质的量为0.2mol,根据质量守恒定律,则A点生成沉淀的物质的量为0.2mol,故答案为:0.2mol;
(3)加入V2mLNaOH时,n(NaOH)=2n(H2SO4)=3mol•L-1×0.1L×2=0.6mol,V(NaOH)=$\frac{0.6mol}{1mol/L}$=0.6L=600mL,故答案为:600mL;
(4)若混合物仍为0.2mol,其中镁的物质的量分数为a,则镁的物质的量为0.2amol,
用100mL 3mol/LH2SO4溶液溶解此混合物后,再加入360mL 1mol/L的NaOH溶液,所得溶液无Al(OH)3沉淀,证明生成的氢氧化铝全部和氢氧化钠反应,由上述分析知:V2=600mL,再加入60mL 1mol•L-1氢氧化钠溶液,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,Al(OH)3+NaOH=NaAlO2+2H2O,Al(OH)3最大取值0.06mol,即0<n(Al)≤0.06mol,n(Mg)+n(Al)=0.2mol,则a的范围为:0.5≤a<1,
故答案为:0.5≤a<1.
点评 本题以图象题的形式考查镁铝单质及其化合物性质、混合物反应的计算,题目难度较大,分析图象各阶段的发生的反应是解题关键,注意掌握常见金属及其化合物性质,明确混合物计算的常用方法.

| X | ||
| Y | ||
| Z |
| A. | X是活泼非金属元素,其最高价氧化物的水化物是一种强酸 | |
| B. | Y是活泼非金属元素,其最高价氧化物的水化物是一种强酸 | |
| C. | Z是较活泼的非金属元素,其最高价氧化物的水化物是一种强酸 | |
| D. | Y单质的氧化性比Z单质的氧化性弱 |
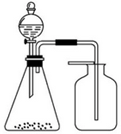
| A. | 浓氨水与固体CaO | B. | 稀盐酸与石灰石 | C. | 稀硝酸与铜片 | D. | 浓盐酸与MnO2 |
| A. | CH3-CH═CH2与 | B. | 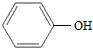 与 与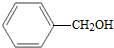 | ||
| C. | CH3COOCH3与CH3CH2COOCH3 | D. | CH3CH2Cl与CH3CHCl-CH2Cl |
| A. | 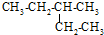 2-乙基丁烷 2-乙基丁烷 | B. | CH2=CHCH2CH3 丁烯 | ||
| C. | 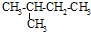 异戊烷 异戊烷 | D. | 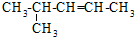 4-甲基-2-戊烯 4-甲基-2-戊烯 |
 只用如图装置(省略夹持装置和净化装置)和表中提供的物质就能完成实验室某些物质(X)的制备实验,其中最合理的是( )
只用如图装置(省略夹持装置和净化装置)和表中提供的物质就能完成实验室某些物质(X)的制备实验,其中最合理的是( )| 选项 | a中的物质 | b中的物质 | c中的物质 | d中的物质 | X中的物质 |
| A | 浓硝酸 | Fe | 稀盐酸 | Na2S | H2SO4 |
| B | 稀硫酸 | Zn | 浓盐酸 | MnO2 | HCl |
| C | 浓硫酸 | C2H5OH | 溴单质 | CCl4 | CH2BrCH2Br |
| D | 浓硫酸 | 浓盐酸 | 浓氨水 | CaO | NH4Cl |
| A. | A | B. | B | C. | C | D. | D |
 硫代硫酸钠(Na2S2O3)是一种重要的化工产品,它受热,遇酸易分解,向Na2CO3和Na2S混合物中通入SO2可制得Na2S2O3,某兴趣小组用如图1实验装置制备硫代硫酸钠晶体(Na2S2O3•5H2O),回答下列问题:
硫代硫酸钠(Na2S2O3)是一种重要的化工产品,它受热,遇酸易分解,向Na2CO3和Na2S混合物中通入SO2可制得Na2S2O3,某兴趣小组用如图1实验装置制备硫代硫酸钠晶体(Na2S2O3•5H2O),回答下列问题: