题目内容
6.下列各对物质,互为同系物的是( )| A. | CH3-CH═CH2与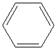 | B. | 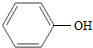 与 与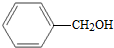 | ||
| C. | CH3COOCH3与CH3CH2COOCH3 | D. | CH3CH2Cl与CH3CHCl-CH2Cl |
分析 结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物.据此概念判断即可.
解答 解:A、CH3-CH═CH是烯烃,含有碳碳双键,属于不饱和链烃, 是苯,属于芳香烃.两者不是同系物,故A错误;
是苯,属于芳香烃.两者不是同系物,故A错误;
B、 羟基直接连在苯环上,属于苯酚,
羟基直接连在苯环上,属于苯酚, 羟基与支链相连,属于醇类,不是同系物,故B错误;
羟基与支链相连,属于醇类,不是同系物,故B错误;
C、CH3COOCH3与CH3CH2COOCH3均含有酯基,分别为乙酸甲酯和丙酸甲酯,分子组成上相差1个CH2原子团,互为同系物,故C正确;
D、CH3CH2Cl为一氯代烃,CH3CHCl-CH2Cl为二氯代烃,含有官能团个数不同,不是同系物,故D错误,故选C.
点评 本题主要考查的是同系物的概念,互为同系物的物质满足以下特点:结构相似、化学性质相似、分子式通式相同、分子式不同、物理性质不同,研究对象是有机物.

练习册系列答案
相关题目
3.现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)已知BA5为离子化合物,写出其电子式: .
.
(2)B元素基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为
该同学所画的电子排布图违背了泡利原理.
(4)G位于ⅦB族d区,该元素的核外电子排布式为[Ar]3d54s2.
(5)检验F元素的方法是焰色反应,请用原子结构的知识解释产生此现象的原因:当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量.
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738kJ•mol-1 I2=1 451kJ•mol-1 I3=7 733kJ•mol-1 I4=10 540kJ•mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
 .
.(2)B元素基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为

该同学所画的电子排布图违背了泡利原理.
(4)G位于ⅦB族d区,该元素的核外电子排布式为[Ar]3d54s2.
(5)检验F元素的方法是焰色反应,请用原子结构的知识解释产生此现象的原因:当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量.
4.下列说法中正确的是( )
| A. | 随着原子序数的递增,第三周期元素的电负性逐渐减小 | |
| B. | 铝的第一电离能比镁的第一电离能大 | |
| C. | K、Na、Li的第一电离能逐渐增大 | |
| D. | 电负性差值大的元素原子之间形成的化学键主要是共价键 |
1.下列解释事实的化学方程式不正确的是( )
| A. | 金属钠在空气中加热,生成淡黄色固体:2Na+O2═Na2O2 | |
| B. | 向硫酸铝溶液中加入氨水制备氢氧化铝:Al3++3NH3•H2O=Al(OH)3↓+3$N{{H}_{4}}^{+}$ | |
| C. | 铁在潮湿的环境中生锈:3Fe+4H2O=Fe3O4+H2↑ | |
| D. | 二氧化氮溶于水有硝酸生成:3NO2+H2O=2HNO3+NO |
18.25℃的四种溶液:①pH=2的CH3COOH溶液②pH=2的HCl溶液③pH=12的氨水④pH=12的NaOH溶液,有关上述溶液的说法,正确的是( )
| A. | ①、④溶液中水电离的c( H+):①>④ | |
| B. | 将②、③溶液混合后pH=7,则消耗溶液的体积:②<③ | |
| C. | 分别向等体积的上述溶液中加入100 ml,水,溶液的pH:③>④>①>② | |
| D. | 将①、④溶液混合后pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7mol•L-1 |
15.下列物质加热熔化时,所克服粒子间相互作用力属于同类型的是( )
| A. | 食盐和金属钠的熔化 | B. | 氯化铵和单质硫的熔化 | ||
| C. | 碘和干冰的升华 | D. | 金刚石和石灰石的熔化 |
16.对于A2+3B2?2C+D的反应来说,以下化学反应速率的表示中反应速率最快的是( )
| A. | v(A2)=0.4 mol/L•s | B. | v(B2)=0.8mol/L•s | C. | v(C)=0.6 mol/L•s | D. | v(D)=0.1 mol/L•s |