题目内容
11.短周期元素X、Y、Z在周期表中的位置如图.下列叙述正确的是( )| X | ||
| Y | ||
| Z |
| A. | X是活泼非金属元素,其最高价氧化物的水化物是一种强酸 | |
| B. | Y是活泼非金属元素,其最高价氧化物的水化物是一种强酸 | |
| C. | Z是较活泼的非金属元素,其最高价氧化物的水化物是一种强酸 | |
| D. | Y单质的氧化性比Z单质的氧化性弱 |
分析 由短周期元素的位置可知,X为He、Y为F、Z为S.
A.稀有气体化学性质不活泼,不存在氧化物含氧酸;
B.F元素没有最高正化合价;
C.Z为硫元素,其最高正化合价氧化物对应水化物为硫酸;
D.非金属性越强,单质氧化性越强.
解答 解:由短周期元素的位置可知,X为He、Y为F、Z为S.
A.X为He,原子最外层为稳定结构,化学性质不活泼,不存在氧化物含氧酸,故A错误;
B.F元素没有最高正化合价,故B错误;
C.Z为硫元素,其最高正化合价氧化物对应水化物为硫酸,硫酸属于强酸,故C正确;
D.同周期自左而右非金属性增强、同主族自上而下非金属性减弱,非金属性越强,单质氧化性越强,故D错误,
故选C.
点评 本题考查元素周期表与元素周期律,比较基础,需要学生熟练掌握元素周期表的结构,注意元素周期表中一些元素的特殊性.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
1.食品香精菠萝酯的生产路线(反应条件略去)如下.下列叙述错误的是( )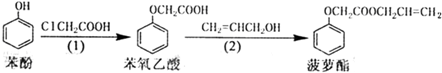
| A. | 步骤(2)产物中残留的烯丙醇可用溴水检验 | |
| B. | 苯酚和菠萝酯均可与酸性KMnO4溶液发生反应 | |
| C. | 苯氧乙酸和菠萝酯均可与NaOH溶液发生反应 | |
| D. | 步骤(1)产物中残留的苯酚可用FeCl3溶液检验 |
2.下列4个有机化合物中,能够发生酯化、加成和氧化3种反应的是( )
①CH2=CHCOOH ②CH2=CHCOOCH3 ③CH2=CHCH2OH ④CH3CH2CH2OH⑤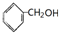
①CH2=CHCOOH ②CH2=CHCOOCH3 ③CH2=CHCH2OH ④CH3CH2CH2OH⑤

| A. | ①③④ | B. | ②④ | C. | ①③⑤ | D. | ①②③⑤ |
19.已知,aK(n-1)+、bLn+、cWn-、dD(n+1)-具有相同的电子层结构,关于K、L、W、D四种元素的叙述正确的是( )
| A. | 气态氢化物的稳定性:D>W | |
| B. | 四种元素一定属于短周期元素 | |
| C. | 最高价氧化物对应水化物的碱性:L>K | |
| D. | 原子序数:L>K>W>D |
16.在元素周期表中,第一、二、三周期中所含元素种数分别为( )
| A. | 2、8、8 | B. | 8、8、18 | C. | 2、8、18 | D. | 8、18、18 |
3.现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)已知BA5为离子化合物,写出其电子式: .
.
(2)B元素基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为
该同学所画的电子排布图违背了泡利原理.
(4)G位于ⅦB族d区,该元素的核外电子排布式为[Ar]3d54s2.
(5)检验F元素的方法是焰色反应,请用原子结构的知识解释产生此现象的原因:当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量.
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738kJ•mol-1 I2=1 451kJ•mol-1 I3=7 733kJ•mol-1 I4=10 540kJ•mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
 .
.(2)B元素基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为

该同学所画的电子排布图违背了泡利原理.
(4)G位于ⅦB族d区,该元素的核外电子排布式为[Ar]3d54s2.
(5)检验F元素的方法是焰色反应,请用原子结构的知识解释产生此现象的原因:当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量.
20.对于元素周期表中下列位置的①~⑩十种元素,请回答有关问题(用元素符号或化学式回答):
(1)只需形成一个共价单键就能达到稳定结构的元素有H、F、Cl.
(2)气态氢化物溶于水呈碱性的化合物是NH3.
(3)⑩号元素最高正价含氧酸只具有共价键.
(4)彼此间形成共价化合物数量最多的两种元素分别是C、H.
(5)含氧量最高的共价化合物是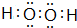 (用电子式表示).
(用电子式表示).
(6)①⑤⑦形成的化合物化学式为NaOH,含有的化学键类型是离子键、共价键.
(7)某元素气态氢化物为H2B,最高价氧化物含B的质量分数为40%,则气态氢化物的化学式为H2S,它与③形成的化合物的化学式为CS2,含有的化学键有共价键.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)气态氢化物溶于水呈碱性的化合物是NH3.
(3)⑩号元素最高正价含氧酸只具有共价键.
(4)彼此间形成共价化合物数量最多的两种元素分别是C、H.
(5)含氧量最高的共价化合物是
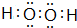 (用电子式表示).
(用电子式表示).(6)①⑤⑦形成的化合物化学式为NaOH,含有的化学键类型是离子键、共价键.
(7)某元素气态氢化物为H2B,最高价氧化物含B的质量分数为40%,则气态氢化物的化学式为H2S,它与③形成的化合物的化学式为CS2,含有的化学键有共价键.