题目内容
4. 只用如图装置(省略夹持装置和净化装置)和表中提供的物质就能完成实验室某些物质(X)的制备实验,其中最合理的是( )
只用如图装置(省略夹持装置和净化装置)和表中提供的物质就能完成实验室某些物质(X)的制备实验,其中最合理的是( )| 选项 | a中的物质 | b中的物质 | c中的物质 | d中的物质 | X中的物质 |
| A | 浓硝酸 | Fe | 稀盐酸 | Na2S | H2SO4 |
| B | 稀硫酸 | Zn | 浓盐酸 | MnO2 | HCl |
| C | 浓硫酸 | C2H5OH | 溴单质 | CCl4 | CH2BrCH2Br |
| D | 浓硫酸 | 浓盐酸 | 浓氨水 | CaO | NH4Cl |
| A. | A | B. | B | C. | C | D. | D |
分析 由图可知,装置为固体与液体反应制备气体,且生成的气体在中间试剂瓶中发生反应生成X中的物质,注意乙烯的制备、氯气的制备及Fe与浓硝酸反应均需要加热,以此来解答.
解答 解:A.常温下Fe与能硝酸发生钝化,不能制备二氧化氮,故A不选;
B.Zn与稀硫酸反应生成氢气,浓盐酸与二氧化锰反应生成氯气需要加热,故B不选;
C.浓硫酸与乙醇反应需要加热,溴易溶于四氯化碳,不能在试剂瓶中发生乙烯与溴的加成反应,故C不选;
D.浓硫酸与浓盐酸混合得到HCl,浓氨水与CaO反应制备氨气,在在试剂瓶中发生HCl、氨气的化合反应生成氯化铵,故D选;
故选D.
点评 本题考查化学实验方案的评价及实验装置综合,为高频考点,把握常见气体的制备原理、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
15.下列物质加热熔化时,所克服粒子间相互作用力属于同类型的是( )
| A. | 食盐和金属钠的熔化 | B. | 氯化铵和单质硫的熔化 | ||
| C. | 碘和干冰的升华 | D. | 金刚石和石灰石的熔化 |
19.某些牙膏中含有的消毒剂三氯生遇含氯自来水能生成三氯甲烷,哥罗芳能导致肝病甚至癌症,已知三氯生的结构简式如图.有关说法正确的是( )

| A. | 三氯生的分子式为:C12H6Cl3O2 | |
| B. | 三氯甲烷只有一种结构,可推知CH4是正四面体 | |
| C. | 三氯生能与NaOH溶液反应 | |
| D. | 常温下,三氯生易溶于水 |
16.对于A2+3B2?2C+D的反应来说,以下化学反应速率的表示中反应速率最快的是( )
| A. | v(A2)=0.4 mol/L•s | B. | v(B2)=0.8mol/L•s | C. | v(C)=0.6 mol/L•s | D. | v(D)=0.1 mol/L•s |
13.下列有机反应中,属于消去反应的是( )
| A. | 苯酚与浓溴水混合 | B. | 溴丙烷与NaOH溶液混合,静置 | ||
| C. | 乙醛与新制的银氨溶液水浴加热 | D. | 1-氯丁烷与乙醇、KOH共热 |
14.如图原电池装置,当装置电路中通过2mol电子时,Cu电极( )
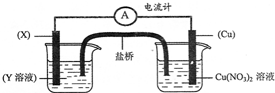

| A. | 一定增重64g | B. | 一定减重64g | ||
| C. | 可能增重64g,也可能减重64g | D. | 既不增重也不减重 |
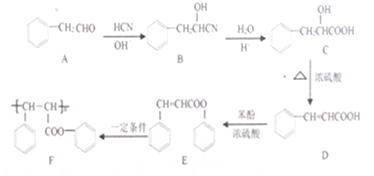
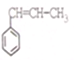 系统命名为1-苯基丙烯,则D的名称(系统命名)是3-苯基丙烯酸.
系统命名为1-苯基丙烯,则D的名称(系统命名)是3-苯基丙烯酸.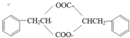 ;其在相同条件下还可能生成一种高聚酯类化合物,写出该反应的化学方程式
;其在相同条件下还可能生成一种高聚酯类化合物,写出该反应的化学方程式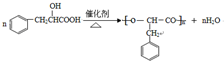 .
.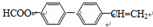 .
.