题目内容
20.下列化合物中,存在离子键的是( )| A. | Br2 | B. | CO2 | C. | NaCl | D. | HCl |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,部分碱、大多数盐及金属氧化物、铵盐中含有离子键,据此分析解答.
解答 解:A.溴分子中Br-Br原子之间只存在共价键,故A错误;
B.二氧化碳分子中C-O原子之间只存在共价键,故B错误;
C.NaCl中钠离子和氯离子之间只存在离子键,故C正确;
D.HCl分子中H-Cl原子之间只存在共价键,故D错误;
故选C.
点评 本题考查离子键和共价键的判断,侧重考查基本概念,明确物质的构成微粒即可解答,知道哪些元素之间易形成离子键,题目难度不大.

练习册系列答案
相关题目
10. CO的应用和治理是当今社会的热点问题.
CO的应用和治理是当今社会的热点问题.
(1)CO能导致镍系催化剂中毒,工业上常用SO2除去原料气中少量CO,生成物为固体S和CO2.写出该反应的化学方程式为2CO+SO2=2CO2+S.
(2)上述反应中,每减少2.24L气体(标准状况下),转移电子数为0.4NA.
CO工业上可用于高炉炼铁,发生如下反应:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g),
已知该反应在不同温度下的平衡常数如表:
(3)下列说法不正确的是cd(选填序号)
a.该反应是一个放热反应
b.该反应的平衡常数表达式是K=$\frac{c(C{O}_{2})}{c(CO)}$
c.其他条件不变,向平衡体系充入CO2气体,K值减小
d.当K值等于1时,反应达到平衡
(4)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是a(选填序号)
a.及时吸收或移出CO2
b.增大反应体系的压强
c.用更高效的催化剂
d.粉碎矿石,增大接触面积
高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g)+Q
(5)从上图可以看出,反应开始到平衡,反应速率v(H2)=0.15mol/(L•min).
(6)甲醇氧化可生成甲酸,能使0.1mol/L的甲酸溶液的电离度与pH值都增大的是ad(选填序号)
a.加水稀释 b.加入少量甲酸钠固体 c.通氯化氢 d.加入少量苛性钠固体.
 CO的应用和治理是当今社会的热点问题.
CO的应用和治理是当今社会的热点问题.(1)CO能导致镍系催化剂中毒,工业上常用SO2除去原料气中少量CO,生成物为固体S和CO2.写出该反应的化学方程式为2CO+SO2=2CO2+S.
(2)上述反应中,每减少2.24L气体(标准状况下),转移电子数为0.4NA.
CO工业上可用于高炉炼铁,发生如下反应:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g),
已知该反应在不同温度下的平衡常数如表:
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
a.该反应是一个放热反应
b.该反应的平衡常数表达式是K=$\frac{c(C{O}_{2})}{c(CO)}$
c.其他条件不变,向平衡体系充入CO2气体,K值减小
d.当K值等于1时,反应达到平衡
(4)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是a(选填序号)
a.及时吸收或移出CO2
b.增大反应体系的压强
c.用更高效的催化剂
d.粉碎矿石,增大接触面积
高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g)+Q
(5)从上图可以看出,反应开始到平衡,反应速率v(H2)=0.15mol/(L•min).
(6)甲醇氧化可生成甲酸,能使0.1mol/L的甲酸溶液的电离度与pH值都增大的是ad(选填序号)
a.加水稀释 b.加入少量甲酸钠固体 c.通氯化氢 d.加入少量苛性钠固体.
8.下列各组化合物中,化学键类型有关叙述正确的是( )
| A. | CaCl2和Na2O2中都只含有离子键 | |
| B. | NaOH和NaHS都既含有离子键,又含有极性键 | |
| C. | CO2和H2S中都只含有非极性键 | |
| D. | H2O2和CS2都既含有极性键,又含有非极性键 |
15.元素Y的原子获得3个电子或元素X的原子失去2个电子后,它们的电子层结构与氖原子的电子层结构相同,X、Y两种元素的单质在高温下得到的化合物的正确化学式是( )
| A. | X2Y3 | B. | X3Y2 | C. | Y2X3 | D. | Y3X2 |
5.下列装置属于原电池的是( )
| A. | 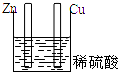 | B. | 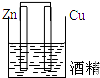 | C. | 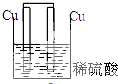 | D. | 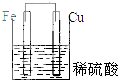 |
12.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn原电池,加快了氢气生成的速率
(2)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4;
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因是当加入的CuSO4溶液超过一定量时,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
(1)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn原电池,加快了氢气生成的速率
(2)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4;
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO 4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因是当加入的CuSO4溶液超过一定量时,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
9.甲苯分子被溴原子取代一个氢原子后,可能形成同分异构体数目是( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
10.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲$\stackrel{丁}{→}$乙$?_{甲}^{丁}$丙.下列有关物质的推断不正确的是( )
| A. | 若甲为焦炭,则丁可能是O2 | B. | 若甲为SO2,则丁可能是NaOH溶液 | ||
| C. | 若甲为Fe,则丁可能是盐酸 | D. | 若甲为NaOH溶液,则丁可能是CO2 |