题目内容
15.元素Y的原子获得3个电子或元素X的原子失去2个电子后,它们的电子层结构与氖原子的电子层结构相同,X、Y两种元素的单质在高温下得到的化合物的正确化学式是( )| A. | X2Y3 | B. | X3Y2 | C. | Y2X3 | D. | Y3X2 |
分析 元素Y的原子获得3个电子与氖原子的电子层结构相,即有10个电子,则Y原子有7个电子为N元素,元素X的原子失去2个电子后,与氖原子的电子层结构相同,则X原子有12个电子,则Y为Mg元素;根据它们的化合价判断.
解答 解:元素Y的原子获得3个电子与氖原子的电子层结构相,即有10个电子,则Y原子有7个电子为N元素,
元素X的原子失去2个电子后,与氖原子的电子层结构相同,则Y原子有12个电子,则X为Mg元素;
N与Mg形成化合物,N为-3价,Mg为+2价,则形成的化合物为:Mg3N2,故选B.
点评 本题考查了原子结构和性质,题目难度不大,侧重于核外电子层结构和化合价的考查.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
6.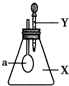 如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压胶头滴管,使液体Y滴入锥形瓶中,振荡,过一会儿,可见小气球a鼓胀起来.气体X和液体Y不可能是( )
如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压胶头滴管,使液体Y滴入锥形瓶中,振荡,过一会儿,可见小气球a鼓胀起来.气体X和液体Y不可能是( )
 如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压胶头滴管,使液体Y滴入锥形瓶中,振荡,过一会儿,可见小气球a鼓胀起来.气体X和液体Y不可能是( )
如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压胶头滴管,使液体Y滴入锥形瓶中,振荡,过一会儿,可见小气球a鼓胀起来.气体X和液体Y不可能是( )| X | Y | |
| A | NH3 | H2O |
| B | SO2 | NaOH溶液 |
| C | CO2 | 6mol•L-1 H2SO4溶液 |
| D | HCl | 6mol•L-1 Na2SO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
3. 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,则反应P4(白磷)+3O2═P4O6的反应热△H为( )
化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,则反应P4(白磷)+3O2═P4O6的反应热△H为( )
 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,则反应P4(白磷)+3O2═P4O6的反应热△H为( )
化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,则反应P4(白磷)+3O2═P4O6的反应热△H为( )| A. | -1 638 kJ/mol | B. | +1 638 kJ/mol | C. | -126 kJ/mol | D. | +126 kJ/mol |
10.下表是元素周期表的一部分,回答有关问题:
(1)写出下列元素符号:(1)N,(6)Si
(2)在这些元素中,最不活泼的元素的结构示意图是 .
.
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的与呈两性的发生反应的化学方程式为3HClO4+Al(OH)3=Al(ClO4)3+3H2O;碱性最强的与呈两性的发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)在(2)(3)(8)(10)这些元素简单离子中,离子半径由大到小的顺序是Cl->K+>F->Na+(填离子符号)
(5)元素(8)、(11)和氧元素形成一种广泛使用杀菌消毒剂,该物质中存在的化学键有离子键、共价键.
(6)用电子式表示由元素(8)和(10)形成化合物的过程: .
.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | (1) | (2) | ||||||
| 三 | (3) | (4) | (5) | (6) | (7) | (8) | (9) | |
| 四 | (10) | (11) | (12) |
(2)在这些元素中,最不活泼的元素的结构示意图是
 .
.(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的与呈两性的发生反应的化学方程式为3HClO4+Al(OH)3=Al(ClO4)3+3H2O;碱性最强的与呈两性的发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)在(2)(3)(8)(10)这些元素简单离子中,离子半径由大到小的顺序是Cl->K+>F->Na+(填离子符号)
(5)元素(8)、(11)和氧元素形成一种广泛使用杀菌消毒剂,该物质中存在的化学键有离子键、共价键.
(6)用电子式表示由元素(8)和(10)形成化合物的过程:
 .
.
20.下列化合物中,存在离子键的是( )
| A. | Br2 | B. | CO2 | C. | NaCl | D. | HCl |
4.甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:

实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜.反应完毕后,黑色的氧化铜转化为红色的铜.下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶.
甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L.乙小组测得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氮气在标准状况下的体积V2L.
请回答下列问题:
(1)检查A装置气密性的操作是连接导管,将导管插入水中;加热试管,导管口有气泡产生;停止加热,导管内有水回流并形成一段稳定的水柱.
(2)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中.
(3)甲小组用所测得数据计算出氨分子中氮、氢的原子个数之比为5V1:7(m1-m2).
(4)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值.为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,得出了合理的实验结果.该药品的名称是碱石灰(氢氧化钠、氧化钙等).

实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜.反应完毕后,黑色的氧化铜转化为红色的铜.下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶.

甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L.乙小组测得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氮气在标准状况下的体积V2L.
请回答下列问题:
(1)检查A装置气密性的操作是连接导管,将导管插入水中;加热试管,导管口有气泡产生;停止加热,导管内有水回流并形成一段稳定的水柱.
(2)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中.
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为① (NH4)2SO4+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+CaSO4. |
| 乙小组 | ②B | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③氢氧化钠溶于氨水后放热,增加氢氧根浓度,使NH3+H2O?NH3•H2O?NH4++OH-向逆反应方向移动,加快氨气逸出. |
(4)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值.为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,得出了合理的实验结果.该药品的名称是碱石灰(氢氧化钠、氧化钙等).
5.下列叙述正确的是( )
| A. | 无论是纯水还是酸性、碱性或中性稀溶液,常温下,其c(H+)•c(OH-)=1×10-14 | |
| B. | 某溶液由水电离出的c(OH-)=10-a mol/L,若a>7时,则该溶液的pH一定为14-a | |
| C. | 0.2 mol/L CH3COOH溶液中的c(H+)是0.1 mol•L-1 CH3COOH溶液中的c(H+)的2倍 | |
| D. | 任何浓度的溶液都可以用pH来表示其酸性的强弱 |
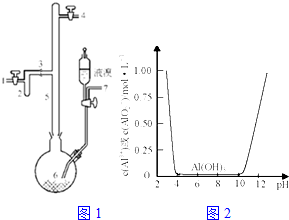 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体.
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体.