题目内容
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,则H3PO2(aq)中离子浓度的顺序为:__________。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银
①H3PO2中,磷元素的化合价为_____
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为___(填化学式);
③NaHPO2为____(填“正盐”或“酸式盐”),其溶液显_____(“弱酸性”,“中性”或“弱碱性”).
(3)H3PO2的工业制法是将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H3PO2),后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:____________。
(4)H3PO2也可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子,阴离子通过):
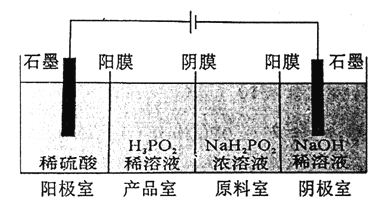
①写出阳极的电极反应式:___________②分析产品室可得到H3PO2的原因:__________
(5)磷酸(H3PO4) 在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如图:
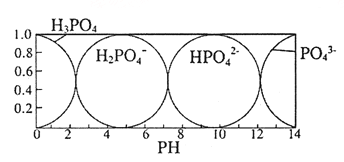
①向Na3PO4溶液中滴入稀盐酸后,pH从10降低到5的过程中发生的主要反应的离子方程式为______。
②从图中推断NaH2PO4溶液中各种微粒浓度大小关系正确的是_______。(填选项字母)
A、c(Na+) >c(H2PO4-) >c(H+) >c(HPO42-) >c(H3PO4)
B、c(Na+) >c(H2PO4-) >c(OH-)>c(H3PO4) >c(HPO42-)
C、c(H+)+ c(Na+)= c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)+ c(H3PO4)
D、c(Na+)= c(H2PO4-)+c(HPO42-)+c(PO43-)+ c(H3PO4)
③假设在25℃时测得0.1 mol·L-1Na3PO4溶液的pH=12,近似计算出Na3PO4第一步水解的水解常数(用Kh表示) Kh=______mol·L-1(忽略Na3PO4第二、第三步水解,结果保留两位有效数字)。
【答案】 c(H+)>c(H2PO2-)>c(OH-) +1价 H3PO4 正盐 弱碱性 2P4+3Ba(OH)2+6H2O=3Ba( H2PO2)2+2PH3↑ 2H2O-4e-==O2↑+4H+ 阳极室产生的H+穿过阳膜扩散至产品室,原料室的H2PO2- 穿过阴膜扩散至产品室,二者反应生成H3PO2 HPO42-+ H+= H2PO4- AD 1.1×10-3mol/L
【解析】(1)因为H3PO2是一元中强酸,只有部分发生电离,电离方程式为H3PO2H++H2PO2-,氢离子来自于酸的电离和水的电离,酸的电离抑制水的电离,故离子浓度大小关系为:c(H+)>c(H2PO2-)>c(OH-);(2)①H3PO2中P元素化合价为+1;②根据H3PO2与Ag+反应中两者物质的量之比为1∶4,4 mol Ag+在反应中得到4 mol e-,1 mol H3PO2则失去4 mol e-,所以P元素将显+5价,产物为H3PO4,即氧化产物为H3PO4;③根据H3PO2是一元中强酸,可以判断NaH2PO2是正盐,属于弱酸强碱盐,因H2PO2-水解而使溶液呈弱碱性;(3)依据氧化还原反应方程式配平原则,得6H2O+2P4+3Ba(OH)2=2PH3↑+3Ba(H2PO2)2;(4)①阳极发生氧化反应,在反应中OH-失去电子,电极反应式为2H2O-4e-=4H++O2↑;②H2O放电产生H+,H+进入产品室,原料室中的H2PO2-穿过阴膜扩散至产品室,二者发生反应:H++H2PO2-=H3PO2,生成H3PO2;(5)①向Na3PO4溶液中滴入稀盐酸后,pH从10降低到5的过程中HPO42-浓度减小、H2PO4- 浓度增大,所以发生的反应为 HPO42-+H+═H2PO4-;②A、钠离子不水解,浓度最大,H2PO4-电离程度大于水解程度,溶液呈酸性,电离程度和水解程度都较小,所以溶液中存在C(Na+)>C(H2PO4-)>C(H+)>C(HPO42-)>C(H3PO4),选项A正确;B、H2PO4-电离程度大于水解程度,所以C(HPO42-)>C(H3PO4),选项B错误;C、溶液中存在电荷守恒C(H+)+C(Na+)=C(OH-)+C(H2PO4-)+2C(HPO42-)+3C(PO43-),选项C错误;D、溶液中存在物料守恒C(Na+)=C(H2PO4-)+C(HPO42-)+C(PO43-)+C(H3PO4),选项D正确;答案选AD;
③ PO43-(aq)+ H2O(l) HPO42- (aq)+ OH-(aq)
起始浓度(mol/L):0.1 0 0
变化浓度(mol/L):0.01 0.01 0.01
平衡浓度(mol/L):0.09 0.01 0.01
Kh═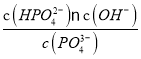 =
=![]() =1.1×10 -3mol/L。
=1.1×10 -3mol/L。

 字词句段篇系列答案
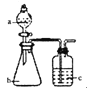
字词句段篇系列答案【题目】用如图所示装置和相应试剂能达到实验目的是:
选项 | 实验目的 | 试剂a | 试剂b | 试剂c | 装置 |
A | 验证非金属性:S>C>Si | 稀硫酸 | Na2CO3 | Na2SiO3溶液 |
|
B | 制备纯净的氯气 | 浓盐酸 | MnO2 | 饱和食盐水 | |
C | 检验溶液X中含有CO32- | 盐酸 | 溶液X | 澄清石灰水 | |
D | 除去Na2CO3中的Na2SO4 | 氯水 | 混合物 | NaOH溶液 |
A. A B. B C. C D. D