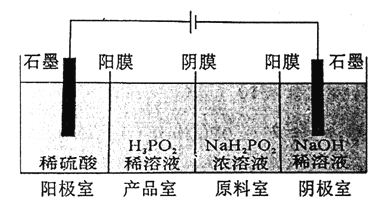
题目内容
【题目】新型高效的甲烷燃料电池两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组进行如下的实验,根据装置图回答下列问题:
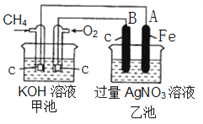
(1)通入CH4的电极的电极反应式是__________ ,A的电极反应式是______________ 。
(2)通电一段时间后,乙池中溶液的pH_________(填“升高”“降低”或“不变”),当乙池中某一电极质量增加 10.8g时,电路中有______ mol电子通过,理论上甲池中共消耗气体 _________mL(标准状况下)。
【答案】 CH4+10OH--8e-=CO32-+7H2O Ag++e-=Ag 降低 0.1 840
【解析】(1)甲烷在反应中失去电子,则通入CH4的电极是负极,电解质是氢氧化钾,则电极反应式是CH4+10OH--8e-=CO32-+7H2O,A电极与电源负极相连,则A电极是阴极,银离子放电,电极反应式是Ag++e-=Ag。(2)B电极是阳极,氢氧根放电,通电一段时间后,乙池产生硝酸,溶液的pH降低,当乙池中某一电极质量增加10.8g即析出银的质量是10.8g,物质的量是0.1mol,所以电路中有0.1mol电子通过,根据电荷守恒可知消耗氧气是0.1mo÷4=0.025mol,消耗甲烷是0.1mol÷8=0.0125mol,所以理论上甲池中共消耗气体(0.025mol+0.0125mol)×22.4L/mol=0.84L=840mL(标准状况下)。

【题目】已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2。某研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物。已知SO3的熔点是16.8 ℃,沸点是44.8 ℃。

(1)装置Ⅱ的试管中不装任何试剂,其作用是______________________________,试管浸泡在50 ℃的水浴中,目的是___________________。
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验气体产物成分。请完成实验设计,填写检验试剂、预期现象与结论。
限选试剂:A.3 mol·L-1H2SO4、B.6 mol·L-1NaOH、C.0.5 mol·L-1BaCl2、D.0.5 mol·L-1Ba(NO3)2、E.0.01 mol·L-1酸性KMnO4溶液。(填所选试剂的序号)
检验试剂 | 预期现象和结论 |
装置Ⅲ的试管中加入________ | 产生大量白色沉淀,证明气体产物中含有SO3 |
装置Ⅳ的试管中加入________ | ____________________ |
(3)装置Ⅴ的作用是防止尾气污染环境,烧杯中应加入的试剂是________。
(4) 配平离子方程式,并在![]() 中填上所需的微粒:_______________________
中填上所需的微粒:_______________________
H++ MnO4-+ Fe2+→ Mn2+ Fe3++ ![]()