��Ŀ����
����Ŀ�����Ṥҵ�з�����Ϊ����������ɷ�ΪSiO2��Fe2O3��Al2O3��MgO��ij̽����ѧϰС���ͬѧ������·����������������н���Ԫ�ص���ȡʵ�飮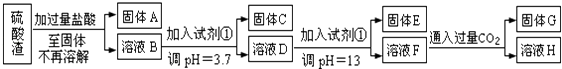
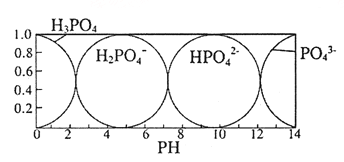
��֪��ҺpH=3.7ʱ��Fe3+�Ѿ�������ȫ��һˮ�ϰ����볣��Kb=1.8��10��5 �� �䱥����Һ��c��OH����ԼΪ1��10��3molL��1 �� ��ش�
��1��д��A������������Һ��Ӧ�����ӷ���ʽ�� ��
��2����������������ʹ���Լ��٣��Ʋ��Լ���Ӧ���� ����������ĸ��ţ�
A.����������Һ
B.������
C.��ˮ
D.ˮ
��3����ҺD������E��������Ҫ������ҺpH=13�����pH��С�����ܵ��µĺ����������дһ�㣩
��4��H�����ʵĻ�ѧʽ����
��5��������ҺF��c��Mg2+��=��25��ʱ��������þ��Ksp=5.6��10��12��
���𰸡�
��1��SiO2+2NaOH=Na2SiO3+H2O
��2��A
��3��þ���ӳ�������ȫ�����������ܽⲻ��ȫ��
��4��NaHCO3
��5��5.6��10��10mol/L
���������⣺�������ijɷ�ΪSiO2��Fe2O3��Al2O3��MgO�������������мӹ�������ʱ����������������Ӧ�����Թ���A�Ƕ������裬��������������������þ�����ᷴӦ��������ҺB���������Ȼ�þ���Ȼ������Ȼ������������ҺB�м��Լ��ٲ�������Һ��pHֵΪ3.7�����������ҺpH=3.7ʱFe3+�Ѿ�������ȫ֪���Լ������ܺ��Ȼ�����Ӧ���ɳ����������Һ������ӷ�Ӧû�г������ɣ������Լ���ֻ����ǿ����Һ������C����������������ҺD�м����Լ��ٲ�������Һ��PHֵΪ13����Һ��ǿ������Һ����Ԫ������Һ����ƫ��������Ӵ��ڣ�þ���Ӻ���������������������þ���������Թ���E��������þ����ҺF�����ʺ���ƫ�����ƺ��Ȼ��ƣ���F��Һ��ͨ�����������̼���壬ƫ�����ƺͶ�����̼��Ӧ����������������������G������������HΪ̼�����ƣ�
��1��ͨ�����Ϸ���֪��A�Ƕ������裬��������������������ܺ�ǿ�Ӧ�����κ�ˮ��
���Է�Ӧ����ʽΪ��SiO2+2NaOH=Na2SiO3+H2O��
�ʴ�Ϊ��SiO2+2NaOH=Na2SiO3+H2O��
��2������ҺB�м��Լ��ٲ�������Һ��PHֵΪ3.7���������֪����ҺpH=3.7ʱFe3+�Ѿ�������ȫ֪���Լ������ܺ��Ȼ�����Ӧ���ɳ����������Һ������ӷ�Ӧû�г������ɣ������Լ���ֻ����ǿ����Һ��������������Aѡ�
��ѡA��
��3����ǿ���������£���Ԫ����ƫ��������Ӵ��ڣ�þԪ����������þ���ڣ�����Һ��PH=13ʱ����Һ��ǿ���ԣ����pH��С�����ܵ��µĺ����þ���ӳ�������ȫ�����������ܽⲻ��ȫ�ȣ�
�ʴ�Ϊ��þ���ӳ�������ȫ�����������ܽⲻ��ȫ�ȣ�
��4��H������Ϊ̼�����ƣ��ʴ�Ϊ��NaHCO3��
��5��c��Mg2+��= ![]() =
= ![]() =5.6��10��10 mol/L
=5.6��10��10 mol/L
�ʴ�Ϊ��5.6��10��10 mol/L��
�������ijɷ�ΪSiO2��Fe2O3��Al2O3��MgO�������������мӹ�������ʱ����������������Ӧ�����Թ���A�Ƕ������裬��������������������þ�����ᷴӦ��������ҺB���������Ȼ�þ���Ȼ������Ȼ������������ҺB�м��Լ��ٲ�������Һ��pHֵΪ3.7�����������ҺpH=3.7ʱFe3+�Ѿ�������ȫ֪���Լ������ܺ��Ȼ�����Ӧ���ɳ����������Һ������ӷ�Ӧû�г������ɣ������Լ���ֻ����ǿ����Һ������C����������������ҺD�м����Լ��ٲ�������Һ��PHֵΪ13����Һ��ǿ������Һ����Ԫ������Һ����ƫ��������Ӵ��ڣ�þ���Ӻ���������������������þ���������Թ���E��������þ����ҺF�����ʺ���ƫ�����ƺ��Ȼ��ƣ���F��Һ��ͨ�����������̼���壬ƫ�����ƺͶ�����̼��Ӧ����������������������G������������HΪ̼�����ƣ���1�����ݶ���������������Ƶ�����д����Ӧ�Ļ�ѧ��Ӧ����ʽ����2����ʹ�����Ӳ����������������Ӳ���������������ֻ����ǿ���3����ǿ���������£���Ԫ����ƫ��������Ӵ��ڣ�þԪ����������þ���ڣ���4��H������Ϊ̼�����ƣ���5������c��Mg2+��= ![]() ���㣮
���㣮

����Ŀ�����ұ��ṩ���ݼ�������ʽṹ֪ʶ����Ӧ��SiCl4(g)+2H2(g)��Si(s)+4HCl(g)������1mol
��������ЧӦ��
��ѧ�� | Si-Cl | H-H | Si-Si | H-Cl |
����(kJ/mol) | 360 | 436 | 176 | 431 |
A.����236kJB.�ų�236kJC.�ų�116kJD.����116kJ