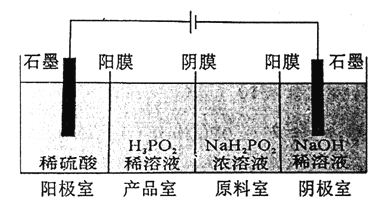
��Ŀ����
����Ŀ���ں��ݵ��ܱ������н������·�Ӧ��A��g��+2B��g��3C��g��+D��g����
��1���˷�Ӧ�����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ��
��v��A��=5molL��1min��1
��v��B��=6molL��1min��1
��v��C��=4.5molL��1min��1
��v��D��=8molL��1min��1
���з�Ӧ���������������ţ���
��2������������֤���÷�Ӧ�Ѵﵽ��ѧƽ��״̬���ǣ����ţ���ͬ�� ��
A.������ѹǿ���ٷ����仯
B.C������������ٷ����仯
C.����������ԭ���������ٷ����仯
D.��ͬʱ��������2n mol B��ͬʱ����n molA
E.�����ܶȱ��ֲ���
F.�����ƽ��Ħ���������ֲ��䣮
���𰸡�
��1����
��2��ABF
���������⣺��Ӧ�����뻯ѧ�������ı�ֵԽ��Ӧ����Խ�죬��
����v��A��=5mol/�� Lmin ���� ![]() =5��
=5��
����v��B��=6mol/�� Lmin ���� ![]() =3��
=3��
����v��C��=4.5mol/�� Lmin ���� ![]() =1.5��
=1.5��
����v��D��=8mol/�� Lmin ���� ![]() =8��
=8��
��Ȼֻ�Т��б�ֵ���Ӧ������죬
���Դ��ǣ��ܣ���2��A��������ѹǿ���ٷ����仯��˵����Ӧǰ���������ʵ������䣬����Ӧ���ʵ����淴Ӧ���ʣ���Ӧ�ﵽƽ��״̬����A��ȷ��
B��C������������ٷ����仯��˵��C�����ʵ����ʵ������䣬����Ӧ���ʵ����淴Ӧ���ʣ���Ӧ�Ѿ��ﵽƽ��״̬����B��ȷ��
C������������ԭ������ʼ�ղ��䣬���ж��Ƿ�ﵽƽ��״̬����C����
D����ͬʱ��������2n mol B��ͬʱ����n molA����ʾ�Ķ�������Ӧ���ʣ����ж����淴Ӧ�����Ƿ���ȣ���D����
E����������������䣬�������������䣬�ܶ�ʼ�ղ��䣬���ж����淴Ӧ�����Ƿ���ȣ���E����
F����������������䣬����������ʵ�������������ƽ��Ħ��������С����ƽ��Ħ���������ֲ��䣬����ƽ��״̬����F��ȷ��
���Դ��ǣ�ABF��
�����㾫����ͨ��������û�ѧƽ��״̬���жϣ�����״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���ȼ����Խ����⣮