题目内容
【题目】一氧化碳和氢气是重要的化工原料,常用于合成甲醇、二甲醚、甲酸甲酯等有机物。
(1)已知![]() 的燃烧热分别是
的燃烧热分别是![]() ,则甲醇与一氧化碳催化合成乙酸的热化学方程式为_____________。
,则甲醇与一氧化碳催化合成乙酸的热化学方程式为_____________。
(2)有人设想将![]() 按下列反应除去
按下列反应除去![]() ,该反应能否自发进行______________(填“是”或“否”),依据是_____________。
,该反应能否自发进行______________(填“是”或“否”),依据是_____________。
(3)向体积可变的密闭容器中投入![]() 和
和![]() ,在不同条件下发生反应:
,在不同条件下发生反应:![]() 。测得
。测得![]() 的平衡转化率随温度、压强的变化如图所示。
的平衡转化率随温度、压强的变化如图所示。
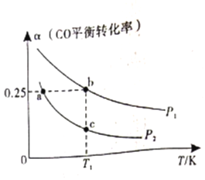
①该可逆反应的![]() __________0(填>”、“<”或“=”)。a、b、c三点对应的平衡常数
__________0(填>”、“<”或“=”)。a、b、c三点对应的平衡常数![]() 的大小关系是____________________。
的大小关系是____________________。
②在恒温恒容条件下进行该反应,能表示反应达到平衡状态的是______________(填字母)。
a. CO的体积分数保持不变
b. 容器内混合气体的密度保持不变
c.容器内混合气体的平均摩尔质量保持不变
d.单位时间内消耗CO的浓度等于生成![]() 的浓度
的浓度
(4)在催化剂作用下,![]() 时分别进行反应:
时分别进行反应:![]() ,
,![]() ,测得CO和
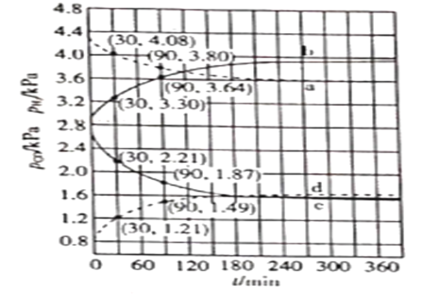
,测得CO和![]() 的分压随时间的变化关系如图所示。起始时,体系中
的分压随时间的变化关系如图所示。起始时,体系中![]() 和
和![]() 相等、
相等、![]() 和
和![]() 相等。计算曲线a的反应在
相等。计算曲线a的反应在![]() 内的平均速率
内的平均速率![]() _______
_______![]() 。
。![]() 时
时![]() 随时间变化关系的曲线是_______,
随时间变化关系的曲线是_______,![]() 时
时![]() 随时间变化关系的曲线是___________。
随时间变化关系的曲线是___________。
(5)一定条件下,![]() 与粉末状氢氧化钠反应生成甲酸钠。已知:常温时,甲酸的电离平衡常数
与粉末状氢氧化钠反应生成甲酸钠。已知:常温时,甲酸的电离平衡常数![]() 。向
。向![]() 的甲酸钠溶液中加入
的甲酸钠溶液中加入![]() 的盐酸,混合液呈__________性(填“酸”或“碱”),溶液中离子浓度从大到小的顺序为__________________。
的盐酸,混合液呈__________性(填“酸”或“碱”),溶液中离子浓度从大到小的顺序为__________________。
【答案】![]() 否 该反应是焓增、熵减的反应,
否 该反应是焓增、熵减的反应,![]() ,反应不能自发进行 <
,反应不能自发进行 < ![]() ac 0.0047 b d 酸
ac 0.0047 b d 酸 ![]()
【解析】
已知![]() 的燃烧热,可以写出三者的燃烧热方程式为:
的燃烧热,可以写出三者的燃烧热方程式为:
①![]()
![]() ,
,
②![]()
![]() ,
,
③![]()
![]() ,再根据题意写出目标方程④,则④=①+②-③,对应
,再根据题意写出目标方程④,则④=①+②-③,对应
答案为![]() 。
。
(2)![]() ,反应能自发进行 ,反之不能。根据题目可知
,反应能自发进行 ,反之不能。根据题目可知![]() ,
,![]() ,则
,则![]() ,反应不能自发进行。
,反应不能自发进行。
答案为否,该反应是焓增、熵减的反应,![]() ,反应不能自发进行。
,反应不能自发进行。
(3)①根据图象,随着温度的升高,![]() 的平衡转化率在降低,说明平衡在往逆向移动,该反应为放热反应,
的平衡转化率在降低,说明平衡在往逆向移动,该反应为放热反应,![]() ;平衡常数只受温度影响,由图象可知,b、c两点处于同一温度,故
;平衡常数只受温度影响,由图象可知,b、c两点处于同一温度,故![]() ,a、c处于同一压强,转化率a>c,a往正向进行的程度更大,
,a、c处于同一压强,转化率a>c,a往正向进行的程度更大,![]() 。
。
故答案为![]() ,
,![]() 。
。
②a.CO的体积分数保持不变,为定值,符合题意;
b./span>混合气体的密度=总质量/总体积,在恒温恒容密闭容器中,密度始终不变,不能作为判据,不合题意;
c.混合气体的平均摩尔质量=总质量/总物质的量,总质量不变,但总物质的量在变,故平均摩尔质量在变,当这个变化的量保持不变是说明达到了平衡,符合题意;
d.![]() 的消耗速率表示正反应速率,
的消耗速率表示正反应速率,![]() 的生成速率也表示正反应速率,不能作为判据,不合题意。
的生成速率也表示正反应速率,不能作为判据,不合题意。
答案选ac。
(4)找出对应的坐标进行计算,![]() 内的平均速率
内的平均速率![]()
![]() ;
; ![]() ,
,![]() ,该反应正向
,该反应正向![]() ,往正向进行的倾向更大,故
,往正向进行的倾向更大,故![]() ,a、b表示
,a、b表示![]() ,c、d表示
,c、d表示![]() ,该反应为放热反应,故升高温度,平衡逆向移动,
,该反应为放热反应,故升高温度,平衡逆向移动,![]() 增加
增加![]() 降低 ,故
降低 ,故![]() 时
时![]() 、
、![]() 分别为b、c,
分别为b、c,![]() 时
时![]() 、
、![]() 分别为a、d。
分别为a、d。
答案为![]() ,b,d。
,b,d。
(5)向![]() 的甲酸钠溶液中加入
的甲酸钠溶液中加入![]() 的盐酸,得到等浓度的
的盐酸,得到等浓度的![]() 的混合溶液,
的混合溶液,![]() 发生水解,平衡常数Kh<Ka,故
发生水解,平衡常数Kh<Ka,故![]() 的电离程度大于
的电离程度大于![]() 的水解程度,溶液呈酸性,溶液中各离子的浓度从大到小顺序为
的水解程度,溶液呈酸性,溶液中各离子的浓度从大到小顺序为
![]() 。
。
答案为酸性,![]() 。
。

 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】过氧乙酸又名过醋酸![]() ,是重要化工原料,也是一种绿色生态杀菌剂,其制法为
,是重要化工原料,也是一种绿色生态杀菌剂,其制法为![]() 。
。
(1)某同学写出了碳原子的4种不同状态的电子排布图:
a.![]() b.
b.![]()
c.![]() d.
d.![]()
其中能量最低的是________(填标号),电子由状态C到状态B所得到的光谱为________光谱(填“原子发射”或“原子吸收”)。
(2)过氧乙酸分子中C原子的杂化方式有________。
(3)乙酸比乙醇易电离出![]() 的原因____________________。
的原因____________________。
(4)熔点:乙酸________硝酸(填“>”、“<”或“=”),理由_________________。
(5)造纸中,用![]() 与纸浆中的过氧乙酸以及过渡金属离子反应以提高漂白效率。硼氢化钠、硼氢化铝被认为是有机化学上的“万能还原剂”。
与纸浆中的过氧乙酸以及过渡金属离子反应以提高漂白效率。硼氢化钠、硼氢化铝被认为是有机化学上的“万能还原剂”。
①两种硼氢化物的熔点如下表所示:
硼氢化物 |
|
|
熔点/℃ | 400 | -64.5 |
解释表中两种物质熔点差异的原因________。
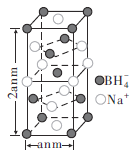
②硼氢化钠晶胞结构如图所示,该晶体中![]() 的配位数为________。已知:硼氢化钠晶体的密度为
的配位数为________。已知:硼氢化钠晶体的密度为![]() ,
,![]() 代表阿伏伽德罗常数的值,则a=________nm(用含
代表阿伏伽德罗常数的值,则a=________nm(用含![]() 、
、![]() 的最简式子表示)。
的最简式子表示)。
【题目】下图为探究铝片和![]() 溶液反应的实验方案及现象。下列说法错误的是( )
溶液反应的实验方案及现象。下列说法错误的是( )
|
| |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为 |
A.![]() 溶液显碱性的原因:
溶液显碱性的原因:![]()
B.加热和![]() 逸出对
逸出对![]() 水解平衡移动方向的影响是相反的
水解平衡移动方向的影响是相反的
C.对比实验I、Ⅲ,说明![]() 溶液能破坏铝表面的氧化膜
溶液能破坏铝表面的氧化膜
D.推测出现的白色沉淀可能是氢氧化铝