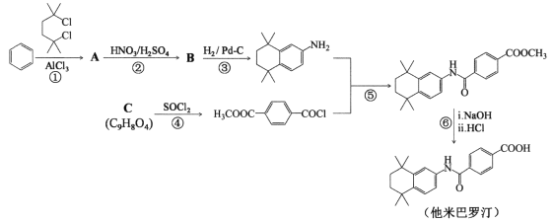
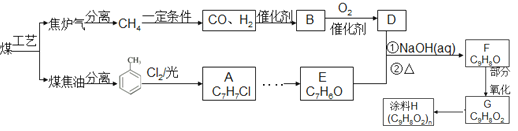
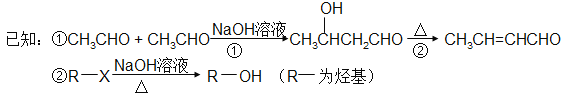
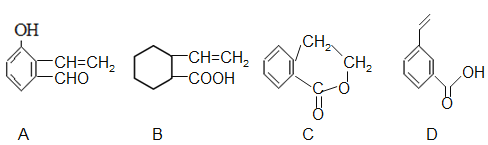
题目内容
【题目】一种新型电池的工作原理如图所示。该电池工作时,下列说法错误的是
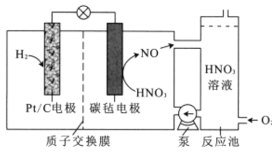
A.Pt/C电极为负极,质子通过交换膜从负极区移向正极区
B.正极的电极反应为NO3-+4H+3e-=NO↑+2H2O
C.反应池中发生总反应4NO+3O2+2H2O=4HNO3,实现HNO3再生
D.理论上,当消耗22.4L(标准状况下)H2时,会消耗1molO2
【答案】D
【解析】
氢气是还原剂,作电池的负极,Pt/C电极为负极,反应为H2-2e-=2H+,质子通过交换膜从负极区移向正极区,硝酸是氧化剂,作电池的正极,正极的电极反应为NO3-+4H+3e-=NO↑+2H2O。
A.氢气是还原剂,作电池的负极,Pt/C电极为负极,反应为H2-2e-=2H+,质子通过交换膜从负极区移向正极区,故A正确;
B.硝酸是氧化剂,作电池的正极,正极的电极反应为NO3-+4H+3e-=NO↑+2H2O,故B正确;
C.从图中可知:NO与O2混合后变成HNO3,进入正极发生电极反应,还原成NO,回到反应池,反应池中发生总反应4NO+3O2+2H2O=4HNO3,实现HNO3再生,故C正确;
D.根据电子守恒,理论上,当消耗22.4L(标准状况下)H2时,会消耗0.5molO2,故D错误;
故选D。

 阅读快车系列答案
阅读快车系列答案【题目】下图为探究铝片和![]() 溶液反应的实验方案及现象。下列说法错误的是( )
溶液反应的实验方案及现象。下列说法错误的是( )
|
| |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为 |
A.![]() 溶液显碱性的原因:
溶液显碱性的原因:![]()
B.加热和![]() 逸出对
逸出对![]() 水解平衡移动方向的影响是相反的
水解平衡移动方向的影响是相反的
C.对比实验I、Ⅲ,说明![]() 溶液能破坏铝表面的氧化膜
溶液能破坏铝表面的氧化膜
D.推测出现的白色沉淀可能是氢氧化铝
【题目】将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g),得到如下三组数据:
CO2(g) + H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
CO | H2O | CO2 | |||
1 | 650 | 4 | 2 | 1.6 | 5 |
2 | 900 | 2 | 1 | 0.4 | 3 |
3 | 2 | 1 | 0.4 | 1 | |
下列说法不正确的是
A. 该反应的正反应为放热反应
B. 实验1中,前5min用CO表示的速率为0.16 mol/(L·min)
C. 实验2中,平衡常数K=1/6
D. 实验3跟实验2相比,改变的条件可能是温度