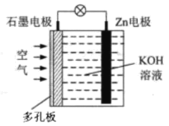
题目内容
【题目】根据碘与氢气反应的热化学方程式:
(i)I2(g)+H2(g) ![]() 2HI(g)+9.48kJ
2HI(g)+9.48kJ
(ii)I2(s)+H2(g)=2HI(g)-26.48kJ
下列判断正确的是
A.254gI2(g)中通入2gH2(g),反应放热9.48kJ
B.1mol固态碘与1mol气态碘所含的能量相差17.00kJ
C.反应(ⅰ)的产物比反应(ⅱ)的产物稳定
D.反应(ⅱ)的反应物总能量比反应(ⅰ)的反应物总能量低
【答案】D
【解析】
A、氢气与碘的反应为可逆反应,反应不能完全进行;
B、根据盖斯定律结合方程式求出,固态碘转化为气态碘的热效应;
C、同一物质稳定性相同;
D、产物相同,放出的热量越多,则反应物具有的能量越高。
A.因为是可逆反应,所以不能进行完全,放热小于9.48kJ,故A错误;
B.由盖斯定律知(Ⅰ)-(Ⅱ)得I2(g)=I2(S)+35.96kJ,故1 mol固态碘与1 mol气态碘所含的能量相差35.96kJ,故B错误;
C.反应(Ⅰ)、反应(Ⅱ)的产物都是HI(g),状态相同,稳定性一样,故C错误;
D.对于同一物质,固态物质的能量比气态物质能量低,故反应(Ⅱ)的反应物总能量比反应(Ⅰ)的反应物总能量低,故D正确;
故选:D。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案【题目】下表是元素周期表的一部分,请回答有关问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素是______。(用元素符号表示)
(2)②③④三种元素的原子半径从大到小的顺序是______(用元素符号表示)
(3)用电子式表示③与⑦形成化合物的过程_______________________。
(4)在①~⑧元素中,元素的最高价氧化物对应的水化物中碱性最强的___。(填化学式)
(5)在⑦与⑩的单质中,化学性质较活泼的是_____。(填化学式)