题目内容
【题目】工业烧碱中常含氯化钠等杂质。
(1)简述检验工业烧碱中含有氯化钠的实验方法___;
(2)写出一种工业烧碱中还可能含有的杂质的化学式___;
(3)某同学采用硝酸银将离子沉淀的方法测定工业烧碱的纯度,取ag样品,经一系列操作,分离并称得氯化银的质量mg,则氢氧化钠纯度计算式为__。已知该测定结果偏低,可能的原因是__;
A.未将氢氧化钠去除 B.氯化银颗粒细小,难以过滤
C.氯化银部分分解 D.氯化银沉淀未洗涤干燥
(4)粗盐提纯过程中,除去硫酸根离子可选用的试剂是__;
A.氯化钡 B.氢氧化钡 C.硝酸钡 D.盐酸
(5)氯化钾的熔点低于氯化钠,从物质结构的角度加以解释___。
【答案】取样,加水溶解,加入稀硝酸酸化,再滴入硝酸银溶液,若有白色沉淀生成说明含有氯化钠 NaClO 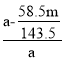 AD AB K+半径大于Na+,因此氯化钾晶体中离子键弱于氯化钠,熔点较低
AD AB K+半径大于Na+,因此氯化钾晶体中离子键弱于氯化钠,熔点较低
【解析】
(1)![]() 的检验用硝酸银,但是要先加足量硝酸中和氢氧化钠,现象是产生白色沉淀;
的检验用硝酸银,但是要先加足量硝酸中和氢氧化钠,现象是产生白色沉淀;
(2)工业制取烧碱: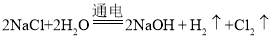 ,氯气有可能和氢氧化钠反应产生次氯酸钠杂质;
,氯气有可能和氢氧化钠反应产生次氯酸钠杂质;
(3)氢氧化钠的纯度为总质量减去杂质氯化钠的总质量然后除以总质量;若测得沉淀质量偏大,则计算所得杂质氯化钠质量偏大,纯度偏小;
(4)除杂时要除掉杂质但是不能引入新杂质;
(5)氯化钾的熔点低于氯化钠是因为![]() 半径大于
半径大于![]() ,因此氯化钾晶体中离子键弱于氯化钠,熔点较低。
,因此氯化钾晶体中离子键弱于氯化钠,熔点较低。
(1)![]() 的检验用硝酸银,但是要先加足量硝酸中和氢氧化钠,现象是产生白色沉淀;
的检验用硝酸银,但是要先加足量硝酸中和氢氧化钠,现象是产生白色沉淀;
故答案为:取样,加水溶解,加入稀硝酸酸化,再滴入硝酸银溶液,若有白色沉淀生成说明含有氯化钠;
(2)工业制取烧碱: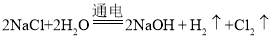 ,产生的氯气有可能和氢氧化钠反应产生次氯酸钠杂质;
,产生的氯气有可能和氢氧化钠反应产生次氯酸钠杂质;
故答案为:![]() ;
;
(3)![]() 的物质的量为:
的物质的量为:![]() ,即杂质氯化钠的物质的量也是
,即杂质氯化钠的物质的量也是![]() ,氯化钠的质量为
,氯化钠的质量为![]() ,氢氧化钠的纯度为总质量减去杂质氯化钠的总质量然后除以总质量,即
,氢氧化钠的纯度为总质量减去杂质氯化钠的总质量然后除以总质量,即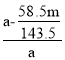 ;
;
A.未除去氢氧化钠,造成生成沉淀质量偏大,计算所得杂质氯化钠质量偏大,纯度偏小,A正确;
B.氯化银颗粒细小,难以过滤,会造成沉淀质量偏小,计算所得杂质氯化钠质量偏小,纯度偏大,B错误;
C.氯化银部分分解为银和氯气,沉淀质量减小,计算所得杂质氯化钠质量减小,纯度偏大,C错误;
D.氯化银沉淀未洗涤干燥,造成沉淀质量偏大, 计算所得杂质氯化钠质量偏大,纯度偏小,D正确;
故答案为: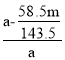 ;AD;
;AD;
(4)除杂时要除掉杂质但是不能引入新杂质,
A.加入氯化钡不会引入新杂质,能够除去硫酸根离子,A正确;
B.加入氢氧化钡会引入氢氧根,但是后续操作还会加入盐酸调节pH,中和氢氧化根离子,B正确;
C.加入硝酸钡可以除掉硫酸根,但是会引入硝酸根杂质,且后续无法出去,C错误;
D.加入盐酸无法除掉硫酸根,D错误;
故答案选:AB;
(5)氯化钾的熔点低于氯化钠是因为![]() 半径大于
半径大于![]() ,因此氯化钾晶体中离子键弱于氯化钠,熔点较低;
,因此氯化钾晶体中离子键弱于氯化钠,熔点较低;
故答案为:![]() 半径大于
半径大于![]() ,因此氯化钾晶体中离子键弱于氯化钠,熔点较低。
,因此氯化钾晶体中离子键弱于氯化钠,熔点较低。

 阅读快车系列答案
阅读快车系列答案


