题目内容
【题目】“张亭栋研究小组”受民间中医启发,发现As2O3对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)为第VA族元素,该族元素的化合物在研究和生产中有着许多重要用途。
(1)N原子的价电子排布式为___,N、P、As原子的第一电离能由大到小的顺序为___。
(2)NH3的沸点比AsH3的沸点高,原因是_____。
(3)立方氮化硼晶体(BN),是一种超硬材料,有优异的耐磨性,其晶胞如图所示。
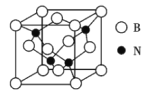
立方氮化硼是____晶体,晶体中N原子的杂化轨道类型为___,B原子的配位数为______。
(4)若立方氮化硼晶胞的边长为362 pm,则立方氮化硼的密度为____g/cm3(只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA)。
【答案】2s22p3 N>P>As NH3能形成分子间氢键 原子 sp3杂化 4 ![]()
【解析】
(1)基态氮原子最外层电子排布式为2s22p3;N、P、As位于同一主族,原子序数逐渐增大,结合第一电离能的变化规律判断;
(2)N和As位于同一主族,NH3的沸点高说明NH3分子间不只是存在范德华力,还存在更强的其他作用力;
(3)根据立方氮化硼晶体(BN)是超硬材料,有优异的耐磨性分析判断晶体类型;立方氮化硼中氮原子与周围的4个硼原子形成四面体结构、硼原子与周围的4个氮原子形成四面体结构,因此立方氮化硼晶胞中应该含有4个N和4个B原子,据此分析解答;
(4)首先根据均摊法计算BN晶胞的质量,再根据ρ=![]() 计算密度。
计算密度。
(1)氮原子的原子序数为7,最外层电子排布式为2s22p3,N的最外层电子就是价电子,即价电了排布式为2s22p3;N、P、As位于同一主族,随着原子序数逐渐增大,原子的第一电离能逐渐减小,所以N、P、As原子的第一电离能由大到小的顺序为N>P>As,故答案为:2s22p3;N>P>As;
(2)NH3的沸点比AsH3的沸点高,是因为氨分子间存在氢键,而AsH3不能,故答案为:氨分子间存在氢键;
(3)立方氮化硼晶体超硬、优异的耐磨性,所以立方氮化硼晶体为原子晶体;立方氮化硼中氮原子与周围的4个硼原子形成四面体结构、硼原子与周围的4个氮原子形成四面体结构,因此晶体中N原子的杂化轨道类型为sp3,N原子的配位数为4,在立方氮化硼晶体中N原子和B原子数目之比为1:1,因此B原子的配位数也为4,故答案为:原子;sp3杂化;4;
(4)BN晶胞中N原子数为4,B原子数=8×![]() +6×
+6×![]() =4,BN晶胞的质量为
=4,BN晶胞的质量为![]() g,立方氮化硼晶胞的体积V=(3.62×10-10cm)3,因此立方氮化硼的密度ρ=
g,立方氮化硼晶胞的体积V=(3.62×10-10cm)3,因此立方氮化硼的密度ρ=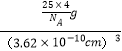 =
=![]() gcm-3,故答案为:
gcm-3,故答案为:![]() 。
。

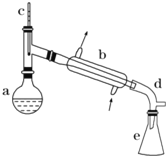
【题目】醇脱水是制取烯烃的常用方法,实验室以环己醇为原料制取环己烯的实验装置如图所示。
反应的化学方程式:
合成反应: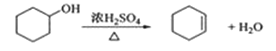
在a中加入40g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中,分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯20g。
可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
回答下列问题:
(1)装置b的名称是___________
(2)加入碎瓷片的作用是_________
(3)本实验中最容易产生的副反应的化学方程式为______________
(4)分离提纯过程中加入无水氯化钙的目的是________________
(5)本实验所得到的环己烯产率是____(填正确答案标号)
A.41% B.50% C.61% D.70%


