题目内容
11.有10mL 0.3mol/L某金属阳离子Rn+的溶液,恰好能使0.2mol/L某碱金属的碳酸盐溶液15mL中的CO${\;}_{3}^{2-}$完全沉淀.则金属阳离子Rn+的n值等于( )| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
分析 计算出10mL 0.3mol/L的溶液中含有的金属阳离子Rn+的物质的量及15mL 0.2mol/L某碱金属的碳酸盐的物质的量,根据电荷守恒可知,n•n(Rn+)=2n(CO32-),据此进行计算.
解答 解:10mL 0.3mol/L的溶液中含有的金属阳离子Rn+的物质的量为:n(Rn+)=0.3mol/L×0.01L=0.003mol,
15mL 0.2mol/L某碱金属的碳酸盐如中含有CO32-的物质的量为:0.2mol/L×0.015L=0.003mol,
根据电荷守恒可知:n•n(Rn+)=2n(CO32-),即:n×0.003mol=2×0.003mol,解得:n=2,
故选B.
点评 本题考查了离子反应的计算,题目难度不大,明确发生反应的实质为解答关键,注意掌握电荷守恒在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
2.用通式为“XYn”表示不同卤素之间靠共用电子对形成的卤素互化物 (已知非金属性:X<Y),其化学性质和卤素单质相似.则下列说法中正确的是( )
| A. | ICl与水反应可生成 HCl 和 HIO,则1mol ICI 参加反应转移电子为 1mol | |
| B. | 某温度下液态IF5发生电离:2IF5?IF4++IF6-,一定有c (IF4+)×c (IF6-)=c (IF5) | |
| C. | BrCl与Mg反应生成MgCl2和MgBr2 | |
| D. | XYn与卤素单质一样都是非极性分子 |
6.下列实验设计能够成功的是( )
| A. | 检验亚硫酸钠试样是否变质:试样$\stackrel{溶解}{→}$$\stackrel{滴加硝酸钡溶液}{→}$白色沉淀$\stackrel{滴加稀盐酸}{→}$沉淀不溶解→说明试样已变质 | |
| B. | 除去粗盐中含有的硫酸钙杂质:粗盐$\stackrel{溶解}{→}$$\stackrel{足量碳酸钠溶液}{→}$$\stackrel{足量氯化钡溶液}{→}$$\stackrel{过滤}{→}$$\stackrel{滤液中滴加盐酸}{→}$$\stackrel{蒸发结晶}{→}$精盐 | |
| C. | 检验某溶液中是否含有Fe2+:试样$\stackrel{滴加硫氰化钾溶液}{→}$溶液颜色无变化$\stackrel{滴加氯气}{→}$溶液变红色→溶液中含有Fe2+ | |
| D. | 证明酸性条件H2O2的氧化性比I2强:NaI溶液$\stackrel{30%过氧化氢、稀硝酸}{→}$$\stackrel{淀粉}{→}$溶液变紫色→氧化性:H2O2>I2 |
16.下列有关实验原理或实验操作正确的是( )
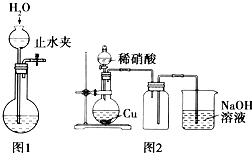

| A. | 用广泛pH试纸测得饱和氯水的pH约为2.2 | |
| B. | 用量筒量取7.60 mL 0.1 mol•L-1盐酸 | |
| C. | 用图1所示的操作可检查装置的气密性 | |
| D. | 实验室用图2所示的装置制取少量的NO |
3.由FeO、Fe2O3、Fe3O4组成的混合物,测得其中铁元素与氧元素的质量比为21:8,则这种混合物中FeO、Fe2O3、Fe3O4的物质的量之比可能为( )
| A. | 1:2:1 | B. | 1:2:3 | C. | 1:3:1 | D. | 1:1:3 |
14.用如图实验装置和方法进行相应实验,能达到实验目的是( )
| A. |  检查装置的气密性 | B. |  制取氨气 | ||
| C. |  进行石油分馏 | D. | 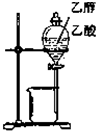 分离乙醇与乙酸 |
15.下列叙述正确的是( )
| A. | 1.00mol NaCl中含有6.02×1023个NaCl分子 | |
| B. | 1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023 | |
| C. | 欲配置1.00L,1.00mol.L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 | |
| D. | 电解58.5g 熔融的NaCl,能产生22.4L氯气(标准状况)、23.0g金属钠 |
