题目内容
19.某盐的混合溶液中含有Na+、Mg2+、Cl-、SO42-离子,测得Na+、Mg2+ 和Cl-的物质的量浓度依次为0.2mol•L-1、0.25mol•L-1、0.4mol•L-1,则c(SO42-)=0.15mol•L-1.分析 溶液中存在电荷守恒,根据电荷守恒c(Na+)+2c(Mg2+)=c(Cl-)+2c(SO42-)计算出溶液中硫酸根离子的物质的量浓度.
解答 解:根据电荷守恒可得:c(Na+)+2c(Mg2+)=c(Cl-)+2c(SO42-),
则:0.2mol•L-1+2×0.25mol•L-1=0.4mol•L-1+2c(SO42-)
解得:c(SO42-)=0.15 mol•L-1
故答案为:0.15 mol•L-1.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确电荷守恒的含义为解答关键,注意掌握物质的量浓度的概念及计算方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
9.下列六组物质中,互为同素异形体的是①,同分异构体的是⑤,同系物的是④,是同一物质的③⑥.(选填序号)
①金刚石和石墨
②CH3CH2Br 和 CH3CH2CH2CH2Cl
③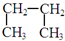 和
和
④CH3CH3 和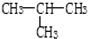
⑤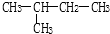 和
和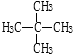
⑥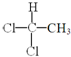 和
和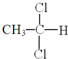
①金刚石和石墨
②CH3CH2Br 和 CH3CH2CH2CH2Cl
③
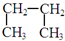 和
和
④CH3CH3 和
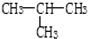
⑤
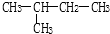 和
和
⑥
 和
和
10.已知A、B、C、D、E是短周期中原子序数依次增大的五种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的两倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 工业上常用电解法制备元素C、D、E的单质 | |
| B. | 元素A、B组成的化合物常温下一定呈气态 | |
| C. | 化合物AE与CE含有相同类型的化学键 | |
| D. | 元素C、D的最高价氧化物对应的水化物之间肯定不能发生反应 |
7.8.34g FeSO4•7H2O(分子量:278)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,下列说法正确的是( )

| A. | 温度为78℃时固体物质M的化学式为FeSO4•5H2O | |
| B. | 取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe3O4 | |
| C. | 在隔绝空气条件下,N得到P的化学方程式为FeSO4•H2O $\frac{\underline{\;高温\;}}{\;}$FeSO4+H2O | |
| D. | 温度为l59℃时固体N的化学式为FeSO4•2H2O |
4.NA 表示阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 1mol 12C原子的质量是12g,1个12C原子的质量是$\frac{12}{{N}_{A}}$g | |
| B. | 在常温常压下,11.2LN2含有分子数为0.5NA | |
| C. | 18g水所含有的氢原子数目为2NA,氧原子数目为NA | |
| D. | 1L 0.1mol•L-1K2SO4溶液中,K+ 和SO42-的离子总数是0.3NA |
11.有10mL 0.3mol/L某金属阳离子Rn+的溶液,恰好能使0.2mol/L某碱金属的碳酸盐溶液15mL中的CO${\;}_{3}^{2-}$完全沉淀.则金属阳离子Rn+的n值等于( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
2. 如图是用高纯度固体二氧化钛生产金属钛的装置示意图,其原理是在较低的电压下,二氧化钛中的氧电离而进入熔融的氯化钙中,最后该电极只剩下纯净的金属钛.已知:熔融状态下,放电强弱为O2->Cl-.下列有关说法正确的是( )
如图是用高纯度固体二氧化钛生产金属钛的装置示意图,其原理是在较低的电压下,二氧化钛中的氧电离而进入熔融的氯化钙中,最后该电极只剩下纯净的金属钛.已知:熔融状态下,放电强弱为O2->Cl-.下列有关说法正确的是( )
 如图是用高纯度固体二氧化钛生产金属钛的装置示意图,其原理是在较低的电压下,二氧化钛中的氧电离而进入熔融的氯化钙中,最后该电极只剩下纯净的金属钛.已知:熔融状态下,放电强弱为O2->Cl-.下列有关说法正确的是( )
如图是用高纯度固体二氧化钛生产金属钛的装置示意图,其原理是在较低的电压下,二氧化钛中的氧电离而进入熔融的氯化钙中,最后该电极只剩下纯净的金属钛.已知:熔融状态下,放电强弱为O2->Cl-.下列有关说法正确的是( )| A. | a电极为阴极 | |
| B. | a电极产生的气泡中主要成分是氯气 | |
| C. | 通电时,O2-、Cl-等向阴极移动 | |
| D. | 该制备工艺中需要定期更换石墨棒 |
3.在FeCl3和CuCl2的混合溶液中加入铁屑,若反应结束后铁有剩余,下列说法正确的是( )
| A. | 溶液中一定存在Fe2+ | B. | 溶液中一定存在Fe3+ | ||
| C. | 溶液中一定存在Cu2+ | D. | 溶液中一定不存在Fe2+ |