题目内容
14.用如图实验装置和方法进行相应实验,能达到实验目的是( )| A. |  检查装置的气密性 | B. |  制取氨气 | ||
| C. |  进行石油分馏 | D. | 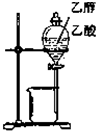 分离乙醇与乙酸 |
分析 A.可通过形成液面差检验气密性;
B.应用氯化铵和氢氧化钙反应制备氨气;
C.温度计和水的进出方向错误;
D.乙醇和乙酸混溶.
解答 解:A.检验气密性,可先关闭止水夹,经长颈漏斗向烧瓶中加水,如形成液面差且液面在一定时间内不变化,可说明气密性良好,故A正确;
B.氯化铵加热分解生成氨气和氯化氢,温度稍低时又可生成氯化铵,应用氯化铵和氢氧化钙反应制备氨气,故B错误;
C.温度计应位于蒸馏烧瓶的支管口,水的进出方向错误,应下进上出,水充满冷凝管,可充分冷凝,故C错误;
D.乙醇和乙酸混溶,不能用分液的方法分离,应用蒸馏的方法,故D错误.
故选A.
点评 本题考查化学实验方案评价,为高频考点,侧重于学生的分析能力、实验能力和评价能力的考查,有利于培养学生的实验能力和学习的积极性,注意把握物质的性质异同以及实验操作方法和注意事项.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.已知A、B、C、D、E是短周期中原子序数依次增大的五种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的两倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 工业上常用电解法制备元素C、D、E的单质 | |
| B. | 元素A、B组成的化合物常温下一定呈气态 | |
| C. | 化合物AE与CE含有相同类型的化学键 | |
| D. | 元素C、D的最高价氧化物对应的水化物之间肯定不能发生反应 |
11.有10mL 0.3mol/L某金属阳离子Rn+的溶液,恰好能使0.2mol/L某碱金属的碳酸盐溶液15mL中的CO${\;}_{3}^{2-}$完全沉淀.则金属阳离子Rn+的n值等于( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
2. 如图是用高纯度固体二氧化钛生产金属钛的装置示意图,其原理是在较低的电压下,二氧化钛中的氧电离而进入熔融的氯化钙中,最后该电极只剩下纯净的金属钛.已知:熔融状态下,放电强弱为O2->Cl-.下列有关说法正确的是( )
如图是用高纯度固体二氧化钛生产金属钛的装置示意图,其原理是在较低的电压下,二氧化钛中的氧电离而进入熔融的氯化钙中,最后该电极只剩下纯净的金属钛.已知:熔融状态下,放电强弱为O2->Cl-.下列有关说法正确的是( )
 如图是用高纯度固体二氧化钛生产金属钛的装置示意图,其原理是在较低的电压下,二氧化钛中的氧电离而进入熔融的氯化钙中,最后该电极只剩下纯净的金属钛.已知:熔融状态下,放电强弱为O2->Cl-.下列有关说法正确的是( )
如图是用高纯度固体二氧化钛生产金属钛的装置示意图,其原理是在较低的电压下,二氧化钛中的氧电离而进入熔融的氯化钙中,最后该电极只剩下纯净的金属钛.已知:熔融状态下,放电强弱为O2->Cl-.下列有关说法正确的是( )| A. | a电极为阴极 | |
| B. | a电极产生的气泡中主要成分是氯气 | |
| C. | 通电时,O2-、Cl-等向阴极移动 | |
| D. | 该制备工艺中需要定期更换石墨棒 |
9.下列化学实验基本操作中正确的是( )
| A. | 酒精灯不慎碰倒起火时,可用湿抹布或沙子盖灭水扑灭,不能用水泼灭 | |
| B. | 蒸馏时,水从冷凝管上口通入,从下口流出 | |
| C. | 蒸发时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| D. | 称量时,将纯碱放在称量纸上置于托盘天平的右盘,将砝码放在托盘天平的左盘 |
6.把3mL NO2气体依次通过下列3个分别装有足量的①饱和NaHCO3溶液,②浓硫酸,③Na2O2固体的装置后,用排水法把残留气体收集到集气瓶中,集气瓶内的气体应是( )
| A. | 1 mL NO | B. | 2 mL NO2和0.5 mL O2 | ||
| C. | 2 mL O2 | D. | 0.25 mL O2 |
3.在FeCl3和CuCl2的混合溶液中加入铁屑,若反应结束后铁有剩余,下列说法正确的是( )
| A. | 溶液中一定存在Fe2+ | B. | 溶液中一定存在Fe3+ | ||
| C. | 溶液中一定存在Cu2+ | D. | 溶液中一定不存在Fe2+ |
4.在其他条件一定时,对反应2A+B2C(正反应放热),A的最大转化率与温度曲线如图,下列叙述正确的( )
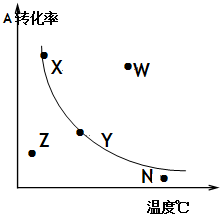

| A. | X或Y两点相应的V正≠V逆 | |
| B. | X、Y两点均已到达平衡状态两点的反应速率均有V正=V逆 | |
| C. | W点表示非平衡状态且V正>V逆 | |
| D. | 相应点的反应速率大小:W>N>Y |