题目内容
16.下列有关实验原理或实验操作正确的是( )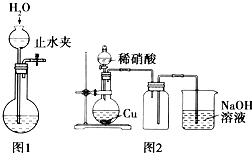
| A. | 用广泛pH试纸测得饱和氯水的pH约为2.2 | |
| B. | 用量筒量取7.60 mL 0.1 mol•L-1盐酸 | |
| C. | 用图1所示的操作可检查装置的气密性 | |
| D. | 实验室用图2所示的装置制取少量的NO |
分析 A.氯水中含HClO,具有漂白性;
B.量筒的感量为0.1mL;
C.关闭止水夹,从长颈漏斗注入水,在导管中形成水柱;
D.NO不能利用排空气法收集.
解答 解:A.氯水中含HClO,具有漂白性,不能利用广泛pH试纸测得饱和氯水的pH,应选pH计,故A错误;
B.量筒的感量为0.1mL,应用量筒量取7.6 mL 0.1 mol•L-1盐酸,故B错误;
C.关闭止水夹,从长颈漏斗注入水,在导管中形成水柱,若一段时间高度不变,则气密性良好,图中装置合理,故C正确;
D.NO不能利用排空气法收集,图中NO收集方法不合理,应选排水法收集,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及pH测定、实验基本操作及气体的制备和收集等,把握实验原理及实验操作为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案
相关题目
7.8.34g FeSO4•7H2O(分子量:278)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,下列说法正确的是( )

| A. | 温度为78℃时固体物质M的化学式为FeSO4•5H2O | |
| B. | 取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe3O4 | |
| C. | 在隔绝空气条件下,N得到P的化学方程式为FeSO4•H2O $\frac{\underline{\;高温\;}}{\;}$FeSO4+H2O | |
| D. | 温度为l59℃时固体N的化学式为FeSO4•2H2O |
4.NA 表示阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 1mol 12C原子的质量是12g,1个12C原子的质量是$\frac{12}{{N}_{A}}$g | |
| B. | 在常温常压下,11.2LN2含有分子数为0.5NA | |
| C. | 18g水所含有的氢原子数目为2NA,氧原子数目为NA | |
| D. | 1L 0.1mol•L-1K2SO4溶液中,K+ 和SO42-的离子总数是0.3NA |
11.有10mL 0.3mol/L某金属阳离子Rn+的溶液,恰好能使0.2mol/L某碱金属的碳酸盐溶液15mL中的CO${\;}_{3}^{2-}$完全沉淀.则金属阳离子Rn+的n值等于( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
2. 如图是用高纯度固体二氧化钛生产金属钛的装置示意图,其原理是在较低的电压下,二氧化钛中的氧电离而进入熔融的氯化钙中,最后该电极只剩下纯净的金属钛.已知:熔融状态下,放电强弱为O2->Cl-.下列有关说法正确的是( )
如图是用高纯度固体二氧化钛生产金属钛的装置示意图,其原理是在较低的电压下,二氧化钛中的氧电离而进入熔融的氯化钙中,最后该电极只剩下纯净的金属钛.已知:熔融状态下,放电强弱为O2->Cl-.下列有关说法正确的是( )
 如图是用高纯度固体二氧化钛生产金属钛的装置示意图,其原理是在较低的电压下,二氧化钛中的氧电离而进入熔融的氯化钙中,最后该电极只剩下纯净的金属钛.已知:熔融状态下,放电强弱为O2->Cl-.下列有关说法正确的是( )
如图是用高纯度固体二氧化钛生产金属钛的装置示意图,其原理是在较低的电压下,二氧化钛中的氧电离而进入熔融的氯化钙中,最后该电极只剩下纯净的金属钛.已知:熔融状态下,放电强弱为O2->Cl-.下列有关说法正确的是( )| A. | a电极为阴极 | |
| B. | a电极产生的气泡中主要成分是氯气 | |
| C. | 通电时,O2-、Cl-等向阴极移动 | |
| D. | 该制备工艺中需要定期更换石墨棒 |
20.下列所陈述的事实与解释均正确的是( )
| 选项 | 实验操作及现象 | 实验结论 |
| A | 用pH试纸测定NaClO溶液的酸碱性,试纸显蓝色 | NaClO水解显碱性 |
| B | 收集铜与浓硝酸反应生成的气体,用冰水混合物冷却降温,气体颜色变浅 | 生成的红棕色NO2气体部分转化为无色气体 |
| C | 向某溶液中加入几滴新制的氯水,再加入2滴KSCN溶液,溶液变为红色 | 原溶液中一定含有Fe2+ |
| D | 甲苯能使酸性高锰酸钾溶液褪色 | 发生了萃取 |
| A. | A | B. | B | C. | C | D. | D |