题目内容
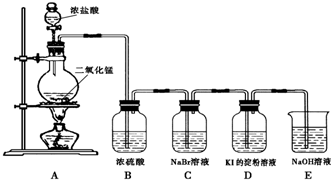
7.某校研究性学习小组设计实验,制取氯气以探究Cl2、Br2、I2的氧化性强弱(制取氯气的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O),实验装置如图所示:【实验探究】
(1)制取氯气的反应??是(填“是”或“不是”)氧化还原反应.
(2)C装置中发生反应的化学方程式为:
Cl2+2NaBr=2NaCl+Br2?.
(3)D装置中溶液变蓝色(填“黄色”或“蓝色”).
(4)E装置的作用是吸收尾气,防止污染.
(5)要制取标况下4.48L的Cl2,需MnO2的质量为?17.4??g.(相对原子质量:H-1 O-16Cl-35.5 Mn-55)
【实验讨论】
有些同学对上述实验装置持有不同看法:甲同学认为:B装置是多余的;乙同学认为:B装置是必须的.
你认为甲(填“甲”或“乙”)同学的看法是正确的.
【结论分析】
实验现象表明,C装置中有Br2生成,D装置中有I2生成,说明Cl2的氧化性比Br2、I2强.但依据本实验能否判断Br2、I2的氧化性强弱,有同学得出不同结论:
丙同学的结论是:可以判断Br2的氧化性比I2强; 丁同学的结论是:无法判断Br2的氧化性比I2强.
你认为丁(填“丙”或“丁”)同学得出的结论是合理的.
【知识联想】
如果要用氯气消毒过的自来水来养金鱼,你认为应该如何对自来水进行处理:
将自来水放在阳光下暴晒(或用强光照射自来水或用紫外线照射自来水)(写一种有效的处理方法).
分析 (1)实验室中利用二氧化锰与浓盐酸制取氯气,属于氧化还原反应;
(2)氯气置换溴化钠中的溴,据此写出方程式即可;
(3)氯气置换出碘化钠中的碘,变为单质,碘单质可以使KI的淀粉溶液变蓝;
(4)氯气有毒,需要尾气吸收;
(5)依据方程式计算即可;
【实验谈论】由于后续实验中仍然存在溶液,故B的干燥是多余的;
【结论分析】进入装置D中的不但有溴蒸汽,还可能会有过量的氯气;
【知识联想】根据氯气与水反应生成的次氯酸见光易分解角度分析.
解答 解:(1)验室制取氯气是二氧化锰和浓盐酸共热,反应的化学方程式为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+C12↑,盐酸中氯元素化合价升高,是氧化还原反应,
故答案为:是;
(2)Cl2的氧化性强于Br2,反应方程式为:Cl2+2NaBr=2NaCl+Br2,
故答案为:Cl2+2NaBr=2NaCl+Br2;
(3)Cl2的氧化性强于I2,故存在反应:Cl2+2NaI=2NaCl+I2,碘单质可以使KI的淀粉溶液变蓝,
故答案为:蓝色;
(4)氯气能溶于氢氧化钠,故E的作用是吸收尾气,
故答案为:吸收尾气,防止污染;
(5)标况下,4.48L氯气的物质的量为:$\frac{44.8L}{22.4L/mol}$=0.2mol,
故依据反应MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+C12↑,设需要二氧化锰的物质的量为xmol,
则有 MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+C12↑
1 1
xmol 0.2mol,
解x=0.2mol,即二氧化锰的质量为:m=0.2mol×87g/mol=17.4g,
故答案为:17.4;
【实验讨论】由于C中反应仍然在溶液中进行,故之间的干燥是不必要的,故甲的看法是正确的,
故答案为:甲;
【结论分析】进入装置D中的不但有溴蒸汽,还可能会有过量的氯气,即置换出碘的不一定是溴,还可能是氯气,故无法判断Br2的氧化性比I2强,
故答案为:丁;
【知识联想】如果要用氯气消毒过的自来水来养金鱼,由于次氯酸见光易分解,可将自来水放在阳光下暴晒,或用强光照射自来水,也可以用紫外线照射自来水,将次氯酸除去,
故答案为:将自来水放在阳光下暴晒(或用强光照射自来水或用紫外线照射自来水).
点评 本题考查了性质实验方案的设计与评价,题目难度中等,明确实验目的及性质实验方案的设计与评价原则为解答关键,试题充分考查了学生的分析、理解能力及化学实验能力.

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案| A. | 向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO42-+20H+═4Fe3++3O2↑+10H2O | |
| B. | 10mL0.5mol/L的明矾溶液与20mL0.5mol/LBa(OH)2溶液混合反应:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ | |
| C. | 铜粉与63%的硝酸反应:Cu+4H++2NO3-═Cu2++2 NO2↑+2H2O | |
| D. | 工业上用纯碱液吸收SO2:CO32-+SO2═CO2+SO32- |
| A. | ①②⑤可能 | B. | ④⑥不可能 | C. | ⑤⑥不可能 | D. | 都可能 |
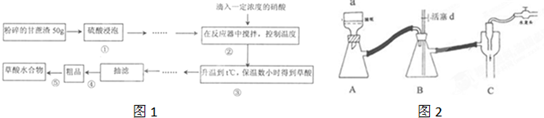
Ⅰ、步骤④是减压抽滤(如图2),其优点是:加快过滤速度、得到较干燥的沉淀,当抽滤完毕或中途停止抽滤时,为了防止自来水倒吸入B装置,最佳的操作是慢慢打开活塞d,然后关闭水龙头.
Ⅱ、该小组同学为了确定产品H2C2O4•xH2O中的x值,进行下列实验:
①取w g产品配成100mL水溶液;
②量取25.00mL草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol•L-1KMnO4溶液滴定. 请回答下列问题:
(1)实验①中,需要用到的玻璃仪器有:玻璃棒、烧杯、胶头滴管和100mL容量瓶.
(2)写出草酸溶液与酸性高锰酸钾溶液反应的离子方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.
(3)若滴定时,前后两次读数分别为a mL和b mL,由此计算出该草酸晶体的x值是$\frac{50W}{9c(b-a)}$-5
Ⅲ、该小组同学在做实验Ⅱ②时发现向草酸溶液中逐滴加入高锰酸钾溶液时,溶液褪色总是先慢后快,即反应速率由小变大.为此,他们设计了实验进行探究:
【实验用品】:仪器:试管(若干个并编号①,②,③…)、胶头滴管(若干支)、秒表
试剂:0.1mol/L H2C2O4溶液、0.1mol/L KMnO4溶液、稀硫酸、MnSO4固体
【实验内容】:实验(1):在①号和②号试管中分别先加入5m1 0.1mol/L H2C2O4溶液,然后各加10滴稀硫酸,且在②号试管中加入少量硫酸锰固体.再在两支试管中各加入5滴0.1mol/LKMnO4溶液.现象如下(表1)
| 编号 | ①号试管 | ②号试管 |
| 褪色时间 | 90s | 5s |
| 实验现象 | 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色. | |
| 编号 | ①号试管 | ②号试管 |
| 褪色时间 | 100s | 90s |
| 实验现象 | 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色. | |
| 编号 | ①号试管 | ②号试管 | ③号试管 |
| 褪色时间 | 88s | 100s | 120s |
| 实验现象 | 均有气泡产生;①号试管的溶液褪色比②、③号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色. | ||
实验(1)得出的结论是Mn2+(或硫酸锰)在反应中起到催化剂的作用,加快了反应速率[或需要Mn2+(硫酸锰)作催化剂],假设1成立.
(2)由实验(2)和实验(3)得出的结论是由表2和表3的实验结果可知:硫酸对草酸和高锰酸钾溶液的反应有影响,加入少量硫酸,可促进草酸和KMnO4溶液反应,而加入大量硫酸,草酸和高锰酸钾溶液的反应速率开始比较慢,随着反应的进行,褪色速率加快,温度对该反应速率影响不大.
| A. | 用含0.1molFeCl3的溶液与足量沸水反应制得得Fe(OH)3胶体中胶粒数为0.1NA | |
| B. | 0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3NA | |
| C. | 将1mol氯气分别通入足量的FeBr2和FeI2溶液中转移电子数均为2NA | |
| D. | 等物质的量的NH4+和OH-含电子数均为10NA |
| A. | 0.5 mol/L | B. | 1 mol/L | C. | 2 mol/L | D. | 4 mol/L |

