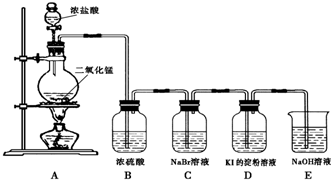
题目内容
2.下列离子方程式不正确的是( )| A. | 向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO42-+20H+═4Fe3++3O2↑+10H2O | |
| B. | 10mL0.5mol/L的明矾溶液与20mL0.5mol/LBa(OH)2溶液混合反应:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ | |
| C. | 铜粉与63%的硝酸反应:Cu+4H++2NO3-═Cu2++2 NO2↑+2H2O | |
| D. | 工业上用纯碱液吸收SO2:CO32-+SO2═CO2+SO32- |
分析 A.发生氧化还原反应,遵循电子、电荷守恒;
B.物质的量比为1:2,反应生成硫酸钡和偏铝酸钾;
C.63%的硝酸为浓硝酸,反应生成硝酸铜、二氧化氮和水;
D.二氧化硫与纯碱反应生成亚硫酸钠和二氧化碳.
解答 解:A.向Na2FeO4溶液中加入稀硫酸产生氧气的离子反应为4FeO42-+20H+═4Fe3++3O2↑+10H2O,故A正确;
B.10mL0.5mol/L的明矾溶液与20mL0.5mol/LBa(OH)2溶液混合反应的离子反应为2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,故B错误;
C.铜粉与63%的硝酸反应的离子反应为Cu+4H++2NO3-═Cu2++2NO2↑+2H2O,故C正确;
D.工业上用纯碱液吸收SO2的离子反应为CO32-+SO2═CO2+SO32-,故D正确;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答本题的关键,侧重复分解反应、氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
10.下列粒子在反应中只能作氧化剂的是( )
| A. | O 2- | B. | Cl 2 | C. | HCl | D. | Fe 3+ |
7.下列实验操作或记录正确的是( )
| A. | 用托盘天平称取2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g | |
| B. | 用量筒测得排水法收集制得的氢气体积为50.28 mL | |
| C. | 用两只250 mL的容量瓶配制0.1 mol•L-1500 mLNaOH溶液 | |
| D. | 常温常压下测得1 mol N2的质量为28 g |
14.下表各组物质中,物质之间不可能实现如图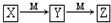 所示转化的是( )
所示转化的是( )
 所示转化的是( )
所示转化的是( )| 选项 | X | Y | Z | M |
| A | Fe(s) | FeCl2 | FeCl3 | Cl2 |
| B | NaOH(aq) | Na2CO3 | NaHCO3 | CO2 |
| C | NH3(g) | NO | NO2 | O2 |
| D | S(s) | SO2 | SO3 | O2 |
| A. | A | B. | B | C. | C | D. | D |
8.下列说法错误的是( )
| A. | s轨道呈球形,p轨道呈哑铃形 | B. | Cu元素在元素周期表的d区 | ||
| C. | 12g二氧化硅中有0.8NA个Si-O键 | D. | H2O中O原子的杂化方式是sp3 |