题目内容
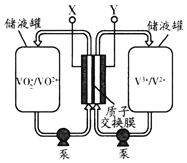
【题目】某原电池的装置如图所示,总反应为 H2(g)+HgO(s)=H2O(1)+Hg(1),其中阴离子交换膜只允许阴离子和水分子通过。下列说法正确的是 ( )
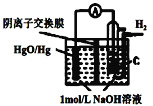
A.正极反应为:HgO(s)2e+H2O=Hg(l)+2OH
B.放电结束后,溶液的碱性不变
C.OH通过离子交换膜从负极向正极移动,保持溶液中电荷平衡
D.每反应 2.24 L(标准状况下)氢气,交换膜通过 0.2 mol 离子
【答案】D
【解析】
A.根据电池反应式知,负极上氢气失电子和OH-反应生成H2O,正极上HgO得电子和水反应Hg和OH-,正极反应式为HgO(s)+2e-+H2O═Hg(l)+2OH-,故A错误;
B.该电池反应中有水生成导致溶液体积增大,KOH不参加反应,则KOH的物质的量不变,则c(KOH)减小,溶液的碱性减弱,故B错误;
C.放电时,电解质溶液中阴离子向负极移动,所以OH-通过离子交换膜从正极移向负极,保持溶液中电荷平衡,故C错误;
D.2.24 L(标准状况下)氢气的物质的量为0.1mol,转移电子0.2mol,则交换膜通过 0.2 molOH-离子,故D正确;
故答案为D。

 津桥教育计算小状元系列答案
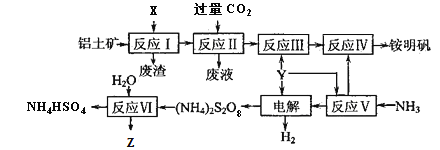
津桥教育计算小状元系列答案【题目】Zn是一种应用广泛的金属。用闪锌矿(主要成分为ZnS,还含有SiO2和少量FeS、CdS、PbS、砷化合物杂质等)为原料制备金属Zn和ZnSO4·7H2O的流程如图所示:

①相关金属离子[c(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
②FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。
回答下列问题:
(1)滤渣1的主要成分除SiO2外还有______,焙烧后产生的气体对环境造成的常见危害为______。
(2)氧化除杂工序中加入ZnO的作用是___________。
(3)制得的ZnSO4·7H2O需洗涤,洗涤晶体时应选用的试剂为____________。
(4)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为___________。不能省去“还原除杂”步骤,直接在“氧化除杂”步骤中除去Cd2+,理由是________。
(5)回收所得的Cd可用于制造镍镉碱性二次电池,电池工作时,正极NiO(OH)转化为Ni(OH)2,则充电时电池的阳极反应式为_____________;沉积锌后的电解液可返回______工序继续使用。
(6)酸浸液中砷元素以AsO33-存在,在氧化除杂时加入酸性KMnO4溶液,KMnO4可与AsO33-发生反应生成FeAsO4,写出该反应的离子方程式为___________。