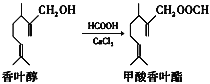
题目内容
【题目】锂离子二次电池正极材料磷酸亚铁锂是应用广泛的正极材料之一。一种制备磷酸亚铁锂的化学方法为:C+4FePO4+2Li2CO3![]() 4LiFePO4+3CO2↑.回答下列问题:
4LiFePO4+3CO2↑.回答下列问题:
(1)Fe失去电子变成为阳离子时首先失去______轨道的电子。
(2)C、O、Li原子的第一电离能由大到小的顺序是______;PO43-的空间构型为______。
(3)C与Si同主族,CO2在高温高压下所形成的晶体结构与SiO2相似,该晶体的熔点比SiO2晶体______(填“高”或“低”)。硅酸盐和SiO2一样,都是以硅氧四面体作为基本结构单元,下图表示一种含n个硅原子的单链式多硅酸根的结构(投影如图1所示),Si原子的杂化类型为______,其化学式可表示为______。

(4)图2表示普鲁士蓝的晶体结构(![]() 个晶胞,K+未标出,每隔一个立方体在立方体体心有一个钾离子)。
个晶胞,K+未标出,每隔一个立方体在立方体体心有一个钾离子)。
①普鲁士蓝晶体中每个Fe3+周围最近且等距离的Fe2+数目为______个。
②晶体中该立方体的边长为a nm,设阿伏加德罗常数为NA,其晶体密度为______gcm-3。
【答案】4s O>C>Li 正四面体 高 sp3 (SiO3)n2n- 6 ![]()
【解析】
(1)失电子先从最外层失去;
(2)同周期主族元素,随着原子序数增大,电负性增强,根据VSEPR理论判断PO43-的空间构型;
(3)CO2在高温高压下所形成的晶体结构与SiO2相似,C的半径小于Si,[SiO4]中Si的价层电子对数为4,根据均摊原理计算化学式;
(4)①根据晶体结构,Fe3+周围的Fe2+离子在顶点上;
②根据![]() 晶胞计算1个整晶胞的质量,再由密度公式
晶胞计算1个整晶胞的质量,再由密度公式![]() 计算晶体密度。
计算晶体密度。
(1)Fe的基态核外电子排布为:[Ar]3d64s2,失电子先从最外层失去,所以先失去4s2电子;
故答案为:4s;
(2)同周期主族元素,随着原子序数增大,电负性增强,所以C、O、Li原子的第一电离能由大到小的顺序是:O>C>Li;对于PO43-,根据VSEPR理论,VP=BP+LP=4+![]() =4,则其空间构型为正四面体;
=4,则其空间构型为正四面体;
故答案为:O>C>Li;正四面体;
(3)CO2在高温高压下所形成的晶体结构与SiO2相似,C的半径小于Si,所以C-O之间的作用力比Si-O之间作用力强,熔点更高,[SiO4]中Si的价层电子对数为4,所以Si原子的杂化类型为sp3;根据均摊原理,一个基本单元中含有1个Si,O的数目为2+2×![]() =3个,一个基本单元所带电荷为2-,则其化学式可表示为:(SiO3)n2n-;
=3个,一个基本单元所带电荷为2-,则其化学式可表示为:(SiO3)n2n-;
故答案为:高;sp3;(SiO3)n2n-;
(4)①根据晶体结构,Fe3+周围的Fe2+离子在顶点上,以其中一个顶点的Fe3+来看,由于晶胞的无隙并置,该Fe3+所在晶胞内有等距最近的Fe2+3个,这3个相当于分别存在三条坐标轴半轴上,则每个Fe3+周围最近且等距离的Fe2+数目为2×3=6个;
故答案为:6;
②取1mol晶胞,则1mol晶胞质量为m=8×(8×![]() ×56+12×
×56+12×![]() ×26)+4×39g=1228g,1mol晶胞即有NA个晶胞,1个整晶胞体积为V=(2a)3×10-21cm3,所以晶体密度为
×26)+4×39g=1228g,1mol晶胞即有NA个晶胞,1个整晶胞体积为V=(2a)3×10-21cm3,所以晶体密度为![]() =
=![]() g/cm3=
g/cm3=![]() g/cm3;
g/cm3;
故答案为:![]() 。
。

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案