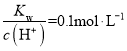题目内容
【题目】根据要求完成下列各小题。
(1)由铜片、锌片和1L0.5mol/L的H2SO4(足量)组成的原电池中,若锌片只发生电化学腐蚀,一段时间后某极产生3.36L(标准状况)的气体。请回答:
①负极是___(填“锌”或“铜”),发生___反应(填“氧化”或“还原”)。

②假设反应后溶液体积不变,反应后溶液的pH为___(用对数表示)。
(2)如图是某燃料电池的示意图,请回答:
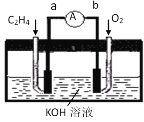
①在导线中电子流动方向为___(用a、b表示)。
②该燃料电池的负极反应式为___。
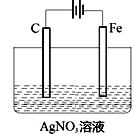
(3)如图是电解未知浓度的硝酸银溶液的示意图,请根据要求答题。
①Fe电极叫做___极,C电极的反应式为___。
②当某电极的固体质量增重21.6g时,整个装置共产生气体(标准状况下)体积2.24L,推断该气体的组成___(包括成分和体积)。
【答案】锌 氧化 1-lg7 a流向b(或a→b) C2H4 +16OH--12e-=2CO32-+10H2O 阴极 4OH--4e-=2H2O+O2 H2和O2;H2体积为0.747L O2体积为1.493L
【解析】
(1)①Zn、Cu、硫酸构成的原电池中,锌比铜活泼,据此分析判断;
②正极铜片上发生的电极反应为2H++2e-=H2↑,该气体为氢气,根据氢气的体积计算出反应的氢离子的物质的量,再计算溶液中剩余氢离子的物质的量和浓度,最后计算pH;
(2)在燃料电池中,通入燃料的为负极,通入氧气的为正极,据此分析解得;
(3)①根据图示,Fe电极连接电源的负极,为阴极,C电极为阳极,据此分析解得;②电解硝酸银溶液时,首先根据析出的银分析判断阴极上是否只有银离子放电,再根据得失电子守恒列式计算。
(1)①Zn、Cu、硫酸构成的原电池中,金属锌做负极,发生失电子的氧化反应,故答案为:锌;氧化;
②正极铜片上发生的电极反应为2H++2e-=H2↑,因此气体为氢气,物质的量=![]() =0.15mol,反应的H+为0.3mol,溶液中剩余氢离子1L×0.5mol/L×2-=0.3mol=0.7mol,c(H+)=
=0.15mol,反应的H+为0.3mol,溶液中剩余氢离子1L×0.5mol/L×2-=0.3mol=0.7mol,c(H+)=![]() =0.7mol/L,pH=- lg0.7=1-lg7,故答案为:1-lg7;
=0.7mol/L,pH=- lg0.7=1-lg7,故答案为:1-lg7;
(2)①在燃料电池中,通入燃料的为负极,通入氧气的为正极,所以导线中电子流动方向为由a到b,故答案为:a→b;
②在燃料电池中,通入燃料的为负极,负极上乙烯发生氧化反应生成碳酸根离子,电极反应式为C2H4 +16OH--12e-=2CO32-+10H2O,故答案为:C2H4 +16OH--12e-=2CO32-+10H2O;
(3)①根据图示,Fe电极连接电源的负极,为阴极,C电极为阳极,阳极上发生氧化反应,溶液中的氢氧根离子放电,电极反应式为4OH--4e-=2H2O+O2,故答案为:阴极;4OH--4e-=2H2O+O2;
②电解硝酸银溶液时,阴极上银离子放电生成银,Ag++e-= Ag,n(Ag)=![]() =0.2mol,转移0.2mol电子,阳极的反应式为4OH――4e-=2H2O+O2↑,因此生成的氧气为
=0.2mol,转移0.2mol电子,阳极的反应式为4OH――4e-=2H2O+O2↑,因此生成的氧气为![]() =0.05mol,标准状况下的体积0.05mol×22.4L/mol= 1.12L<2.24L,说明阴极上还生成了氢气,设生成氢气的物质的量为x,则阴极转移的电子为0.2mol+2x,则阳极放出的氧气为
=0.05mol,标准状况下的体积0.05mol×22.4L/mol= 1.12L<2.24L,说明阴极上还生成了氢气,设生成氢气的物质的量为x,则阴极转移的电子为0.2mol+2x,则阳极放出的氧气为![]() mol,因此
mol,因此![]() mol+x=
mol+x=![]() ,解得:x=
,解得:x=![]() mol,因此氢气的体积=
mol,因此氢气的体积=![]() mol×22.4L/mol= 0.747L,氧气的体积为2.24L-0.747L=1.493L,故答案为:H2体积为0.747L O2体积为1.493L。
mol×22.4L/mol= 0.747L,氧气的体积为2.24L-0.747L=1.493L,故答案为:H2体积为0.747L O2体积为1.493L。