题目内容
15.在甲、乙两烧杯溶液中,共含有Na+、H+、Cu2+、Cl-、CO32-、OH- 6种离子.已知甲烧杯的溶液含其中3种离子并呈蓝绿色,则乙烧杯的溶液中含有的另3种离子是( )| A. | Cu2+、H+、Cl- | B. | Na+、CO32-、Cl- | C. | Na+、H+、Cl- | D. | Na+、OH-、CO32- |
分析 根据甲烧杯的溶液呈蓝色说明含有Cu2+,所以与之不共存的CO32-、OH-离子在乙烧杯中,乙烧杯的阳离子不可能为H+,只能为Na+进行解答.
解答 解:甲烧杯的溶液呈蓝色含有Cu2+,而CO32-、OH-离子不能与Cu2+离子大量共存,故只能存在于乙烧杯中,乙烧杯中含有CO32-、OH-离子,则H+离子只能存在于甲烧杯中,根据溶液的电中性,甲中还应有Cl-,乙中还应有Na+,故甲中含有的离子为Cu2+、H+、Cl-,乙中含有的离子为Na+、OH-、CO32-.
故选:D.
点评 本题考查离子共存问题,注意从铜离子的颜色作为本题的突破口,本题难度不大.

练习册系列答案
相关题目
6.苯甲酸甲酯是一种重要的工业原料,某研究性学习小组的同学拟用下列装置制取高纯度的苯甲酸甲酯.
有关数据如下表:
请回答下列问题:
(1)在烧瓶中混合有机物及浓硫酸的方法是先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸,在实际实验中,甲醇、苯甲酸的物质的量之比远大于其理论上的物质的量之比,目的是提高苯甲酸的利用率.装置C中除甲醇、苯甲酸与浓硫酸外还需要放置沸石(或碎瓷片).
(2)C装置上部的冷凝管的主要作用是冷凝回流.
(3)制备和提纯苯甲酸甲酯的操作的先后顺序为(填装置字母代号)CFEADB.
(4)A装置锥形瓶中Na2CO3的作用是除去酯中的苯甲酸;D装置的作用是除去没有反应完的Na2CO3;当B装置中温度计显示199.6℃时可收集苯甲酸甲酯.

有关数据如下表:
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 水溶性 | |
| 苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
| 甲醇 | -97 | 64.3 | 0.79 | 互溶 |
| 苯甲酸甲酯 | -12.3 | 199.6 | 1.09 | 不溶 |
(1)在烧瓶中混合有机物及浓硫酸的方法是先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸,在实际实验中,甲醇、苯甲酸的物质的量之比远大于其理论上的物质的量之比,目的是提高苯甲酸的利用率.装置C中除甲醇、苯甲酸与浓硫酸外还需要放置沸石(或碎瓷片).
(2)C装置上部的冷凝管的主要作用是冷凝回流.
(3)制备和提纯苯甲酸甲酯的操作的先后顺序为(填装置字母代号)CFEADB.
(4)A装置锥形瓶中Na2CO3的作用是除去酯中的苯甲酸;D装置的作用是除去没有反应完的Na2CO3;当B装置中温度计显示199.6℃时可收集苯甲酸甲酯.
3.类推法是科学学习的重要方法之一.在学习了卤族元素的各种性质后,如下表所示,表格提供的是氧族元素的部分性质.请结合元素周期律完成下列问题:
(1)硒的熔点范围可能是113~450℃.
(2)碲的化合价可能有-2,+4,+6.
(3)硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是H2Te>H2Se>H2S(填化学式).
(4)氢硒酸有较强的还原性(填“氧化性”或“还原性”).因此放在空气中长期保存易变质,其可能发生的化学方程式为2H2Se+O2=2H2O+2Se↓.
(5)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:Al2Te3+6H2O----Al(OH)3↓+H2Te↑
| 元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | 450 | |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2 反应情况 | 点燃时 易化合 | 加热化合 | 加热难 化合 | 不能直 接化合 |
(2)碲的化合价可能有-2,+4,+6.
(3)硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是H2Te>H2Se>H2S(填化学式).
(4)氢硒酸有较强的还原性(填“氧化性”或“还原性”).因此放在空气中长期保存易变质,其可能发生的化学方程式为2H2Se+O2=2H2O+2Se↓.
(5)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:Al2Te3+6H2O----Al(OH)3↓+H2Te↑
10.下列物质互为同分异构体的是( )
| A. | 2-甲基丁烷和异戊烷 | B. | 分子量相同而结构不同的两种物质 | ||
| C. |  和 和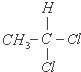 | D. | 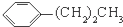 和 和 |
20.一块金属钠置于空气中,最终得到的产物是( )
| A. | Na2O | B. | NaOH | C. | Na2O2 | D. | Na2CO3 |
7.相同温度下,根据三种酸的电离常数,下列判断正确的是( )
| 酸 | HX | HY | HZ |
| 电离常数K | 9×10-7 | 9×10-6 | 10-2 |
| A. | 三种酸的强弱关系:HX>HY>HZ | |
| B. | 反应HZ+Y-═HY+Z-能够发生 | |
| C. | 相同温度下,0.1 mol•L-1的HX、HY、HZ溶液,HX与锌反应一定最快 | |
| D. | 相同温度下,1 mol•L-1 HX溶液的电离常数大于0.1 mol•L-1 HX |
5. 某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?合理(填“合理”或“不合理”).
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂NaOH溶液,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是B(填序号).
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液.
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与过量的很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为H++OH-═H2O.
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为NH4++OH-═NH3•H2O;上述现象说明溶液中Al3+、Fe3+、H+结合OH-的能力比NH4+强(填离子符号).
(3)B与A的差值为0.08mol.
(4)B点对应的沉淀的物质的量为0.032mol,C点对应的氢氧化钠溶液的体积为7mL.
 某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂NaOH溶液,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是B(填序号).
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液.
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与过量的很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为H++OH-═H2O.
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为NH4++OH-═NH3•H2O;上述现象说明溶液中Al3+、Fe3+、H+结合OH-的能力比NH4+强(填离子符号).
(3)B与A的差值为0.08mol.
(4)B点对应的沉淀的物质的量为0.032mol,C点对应的氢氧化钠溶液的体积为7mL.

 某同学欲配制4mol•L-l的硫酸,但实验室只有三种不同浓度的硫酸:①280ml.1mol•L-l硫酸;②220mL 25%硫酸(p=l.18g.mL-l);③足量的18mol•L-l的浓硫酸.
某同学欲配制4mol•L-l的硫酸,但实验室只有三种不同浓度的硫酸:①280ml.1mol•L-l硫酸;②220mL 25%硫酸(p=l.18g.mL-l);③足量的18mol•L-l的浓硫酸.