题目内容
20.一块金属钠置于空气中,最终得到的产物是( )| A. | Na2O | B. | NaOH | C. | Na2O2 | D. | Na2CO3 |
分析 钠性质活泼,露置于空气中与空气中氧气反应生成氧化钠,氧化钠与空气中的水蒸气反应生成白色固体氢氧化钠,氢氧化钠易潮解表面变成溶液,氢氧化钠是强碱与空气中的酸性气体二氧化碳反应,生成白色带结晶水的固体Na2CO3.10H2O,十水碳酸钠易风化生成白色粉末碳酸钠,据此解答.
解答 解:钠性质活泼,露置于空气中与空气中氧气反应生成氧化钠,方程式:4Na+O2=2Na2O,氧化钠与空气中的水蒸气反应生成白色固体氢氧化钠,方程式Na2O+H2O=2NaOH,氢氧化钠易潮解表面变成溶液,氢氧化钠是强碱与空气中的酸性气体二氧化碳反应,生成白色带结晶水的固体Na2CO3.10H2O,方程式为:
2NaOH+CO2=Na2CO3+H2O,Na2CO3+10H2O=Na2CO3•10H2O,十水碳酸钠易风化生成白色粉末碳酸钠,方程式:Na2CO3•10H2O=Na2CO3+10H2O,
故选:D.
点评 金属钠暴露在空气中发生现象体现了钠及其化合物的性质,根据钠及其化合物的性质可以解释发生的现象,侧重考查学生对基础知识的掌握,题目难度不大.

练习册系列答案
相关题目
11.工业燃烧煤、石油等化石燃料释放出大量氨氧化物NO3、CO2、SO2等气体,严重污染空气.对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用.
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ•mol-1
N2(g)+2O2(g)=2NO2(g)△H=+133kJ•mol-1
H2O(g)=H2O(l)△H=-44kJ•mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
Ⅱ.脱碳:向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H<0
(1)①下列叙述能说明此反应达到平衡状态的是de.
a.混合气体的平均摩尔质量保持不变
b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等
d.混合气体的密度保持不变
e.1molCO2生成的同时有3molH-H键断裂
②CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t4CO2的浓度随时间的变化.

(2)改变温度,使反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0中的所有物质都为气态.起始温度体积相同(T1℃、2L密闭容器).反应过程中部分数据见下表:
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ)<K(Ⅱ)(填“>”、“<”或“=”).
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=0.025mol/(L.min);;在反应Ⅰ的条件下,该反应的平衡常数为$\frac{4}{27}$
③对反应Ⅰ,在其它条件不变,若30min时只改变一个条件,此时H2的物质的量浓度为1.6mol/L,则该条件可能为减少CO2的浓度,增大甲醇或水蒸气浓度,或升高温度.(写出两个情况即可)
④对反应Ⅰ,若30min时只向容器中再充入1molCO2(g)和1molH2O(g),则平衡不移动(填“正向”、“逆向”或“不”).
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ•mol-1
N2(g)+2O2(g)=2NO2(g)△H=+133kJ•mol-1
H2O(g)=H2O(l)△H=-44kJ•mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
Ⅱ.脱碳:向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H<0
(1)①下列叙述能说明此反应达到平衡状态的是de.
a.混合气体的平均摩尔质量保持不变
b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等
d.混合气体的密度保持不变
e.1molCO2生成的同时有3molH-H键断裂
②CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t4CO2的浓度随时间的变化.

(2)改变温度,使反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0中的所有物质都为气态.起始温度体积相同(T1℃、2L密闭容器).反应过程中部分数据见下表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应Ⅰ恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ绝热恒容 | 0min | 0 | 0 | 2 | 2 |
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=0.025mol/(L.min);;在反应Ⅰ的条件下,该反应的平衡常数为$\frac{4}{27}$
③对反应Ⅰ,在其它条件不变,若30min时只改变一个条件,此时H2的物质的量浓度为1.6mol/L,则该条件可能为减少CO2的浓度,增大甲醇或水蒸气浓度,或升高温度.(写出两个情况即可)
④对反应Ⅰ,若30min时只向容器中再充入1molCO2(g)和1molH2O(g),则平衡不移动(填“正向”、“逆向”或“不”).
8.某元素的原子最外层只有一个电子,它跟卤素原子结合时( )
| A. | 一定形成共价键 | B. | 可能是共价键,也可能是离子键 | ||
| C. | 一定是离子键 | D. | 以上说法都不对 |
15.在甲、乙两烧杯溶液中,共含有Na+、H+、Cu2+、Cl-、CO32-、OH- 6种离子.已知甲烧杯的溶液含其中3种离子并呈蓝绿色,则乙烧杯的溶液中含有的另3种离子是( )
| A. | Cu2+、H+、Cl- | B. | Na+、CO32-、Cl- | C. | Na+、H+、Cl- | D. | Na+、OH-、CO32- |
5.下列说法正确的是( )
| A. | 向磁性氧化铁溶解于足量稀盐酸后的溶液中滴加酸性KMnO4溶液,紫红色消失,表明溶液中含有Fe2+ | |
| B. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | FeCl3、FeCl2、Fe(OH)3三种化合物都可以通过化合反应制得 | |
| D. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
12.有些化学仪器加热时需要放在石棉网上,但也有一些仪器可以直接在酒精灯上加热,下列各组仪器中可以用酒精灯直接加热的一组是( )
| A. | 坩埚、烧杯 | B. | 试管、燃烧匙 | C. | 蒸发皿、平底烧瓶 | D. | 蒸发皿、圆底烧瓶 |
9.下列实验设计与结论不相符的是( )
| A. | 某溶液中加入 Ba(NO3)2溶液,再滴加稀盐酸,出现白色沉淀且不溶解,则原溶液中可能含有 SO${\;}_{3}^{2-}$ | |
| B. | 某气体能使湿润的蓝色石蕊试纸变红,则该气体一定是酸性氧化物 | |
| C. | 乙醇中混有乙酸,加氢氧化钠后蒸馏即可得到纯净的乙醇 | |
| D. | 在分液漏斗中加入溴水,然后再加入适量的四氯化碳,振荡后静置,溴可萃取到四氯化碳中 |
10.化学中常用图象直观地描述化学反应的进程或结果.下列图象描述正确的是( )
| A. | 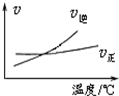 根据图可判断可逆反应“A2(g)+3B2(g)?2AB3(g)”的△H<0 | |
| B. | 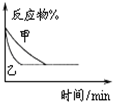 如图表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| C. | 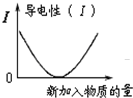 如图可表示醋酸溶液中通入氨气至过量过程中溶液导电性的变化 | |
| D. | 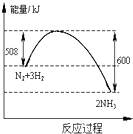 如图④是N2与H2合成氨的能量变化曲线,可确定该反应1mol N2和4molH2充分反应时放热一定等于92kJ |



