题目内容
【题目】工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺。
I.火法熔炼工艺:将处理过的黄铜矿加入石英,再通入空气进行焙烧,即可制得粗铜。
(1)焙烧的总反应式可表示为:2CuFeS2+ 2SiO2+5O2=2Cu+2FeSiO3+4SO2该反应的氧化剂是___________。
(2)下列处理SO2的方法,不合理的是_____
A高空排放 B用纯碱溶液吸收制备亚硫酸钠
C用氨水吸收后,再经氧化制备硫酸铵 D用BaCl2溶液吸收制备BaSO3
(3)炉渣主要成分有FeO 、Fe2O3 、SiO2、Al2O3等,为得到Fe2O3加盐酸溶解后,后续处理过程中未涉及到的操作有____________。
A过滤 B加过量NaOH溶液 C蒸发结晶 D灼烧 E加氧化剂
II.FeCl3溶液浸取工艺:其生产流程如下图所示
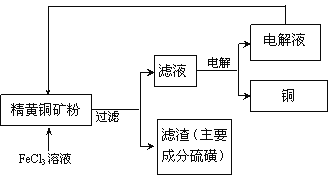
(4)浸出过程中,CuFeS2与FeCl3溶液反应的离子方程式为_____________。
(5)该工艺流程中,可以循环利用的物质是____ (填化学式)。
(6)若用石墨电极电解滤液,写出阳极的电极反式_____________。
(7)黄铜矿中含少量Pb,调节C1一浓度可控制滤液中Pb2+的浓度,当c(C1一)=2mo1·L-1时溶液中Pb2+物质的量浓度为___mol·L-1。[已知KSP(PbCl2)=1 x 10一5]
【答案】CuFeS2、O2 A、D C CuFeS2+4Fe3+=Cu2++5Fe2++2S FeCl3 Fe2+-e-=Fe3+ 2.5×10-6
【解析】
I.(1)根据焙烧的反应式渣铜、硫、氧元素的化合价变化确定氧化剂。
(2)SO2的可以被碱性物质吸收。
(3)炉渣中的SiO2不溶于盐酸,过滤除去。Al2O3可以用过量NaOH溶液除去,+2价铁需要加氧化剂氧化为+3价,得到的Fe(OH)3灼烧后得到Fe2O3 。
II.黄铁矿粉加入FeCl3溶液,发生氧化还原反应,得到硫和CuCl2和FeCl2,滤液电解,Cu2+得到电子生成铜,Fe2+失去电子转变为Fe3+,FeCl3可以循环使用。
(1)根据方程式2CuFeS2+ 2SiO2+5O2=2Cu+2FeSiO3+4SO2知,铜元素的化合价降低,氧元素的化合价降低,因此该反应中氧化剂是CuFeS2和O2。
(2)SO2是大气污染物,A错;用纯碱溶液吸收制备亚硫酸钠,可以防止污染,B正确;用氨水吸收后,再经氧化制硫酸铵,也可以防止污染,C正确;SO2不能溶于氯化钡溶液,D错;答案选AD。
(3)炉渣主要成分是FeO、Fe2O3、SiO2、Al2O3等,为得到Fe2O3,加盐酸溶解后,需要过滤出二氧化硅,然后再加入氧化剂将溶液中的亚铁离子氧化为三价铁离子,再加入过量氢氧化钠溶液后主要成分是氢氧化铁沉淀。过滤、洗涤、灼烧就可以得到三氧化二铁,所以未涉及的实验操作是蒸发结晶。
(4)过滤得到的滤渣中含有硫单质,这说明CuFeS2与FeCl3溶液发生氧化还原反应,即CuFeS2+4Fe3+=Cu2++5Fe2++S。
(5)电解时产生的电解液又可以与黄铜矿反应,所以该工艺流程中,可以循环利用的物质是FeCl3。
(6)电解池中阳极失去电子,因此若用石墨做电极电解滤液,则亚铁离子在阳极失去电子,所以阳极反应是Fe2+-e-=Fe3+。
(7)已知KSP(PbCl2)=1×10一5,因此当溶液中c(C1一)=2mo1·L-1时溶液中Pb2+物质的量浓度为![]() mol·L-1。
mol·L-1。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案