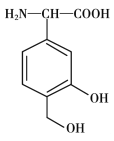
题目内容
【题目】工业上用CO和H2生产燃料甲醇。一定条件下密闭容器中发生反应,测得数据曲线如下图所示(反应混合物均呈气态)。下列说法错误的是
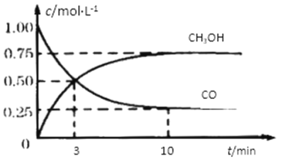
A.反应的化学方程式:CO+2H2![]() CH3OH
CH3OH
B.反应进行至3分钟时,正、逆反应速率相等
C.反应至10分钟,(CO) = 0.075 mol/L·min
D.增大压强,平衡正向移动,K不变
【答案】B
【解析】
由图可知,CO的浓度减小,甲醇浓度增大,且平衡时c(CO)=0.25mol/L,c(CH3OH)=0.75mol/L,转化的c(CO)=0.75mol/L,结合质量守恒定律可知反应为CO+2H2CH3OH,3min时浓度仍在变化,浓度不变时为平衡状态,且增大压强平衡向体积减小的方向移动,以此来解答。
A.用CO和H2生产燃料甲醇,反应为CO+2H2CH3OH,故A正确;
B.反应进行至3分钟时浓度仍在变化,没有达到平衡状态,则正、逆反应速率不相等,故B错误;
C.反应至10分钟,(CO)=![]() =0.075mol/(Lmin),故C正确;
=0.075mol/(Lmin),故C正确;
D.该反应为气体体积减小的反应,且K与温度有关,则增大压强,平衡正向移动,K不变,故D正确;
故答案为B。

练习册系列答案
 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目