题目内容
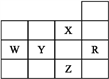
【题目】(1)常温下,将1mLpH=1的H2SO4溶液加水稀释到100mL,稀释后的溶液中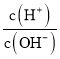 =_________。
=_________。
(2)某温度时,测得0.01mol·L-1的NaOH溶液的pH 为11,则该温度下水的离子积常数Kw=_________。该温度_________(填“高于“或“低于")25℃。
(3)常温下,设pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为c2,则![]() =_________。
=_________。
(4)常温下,pH=13的Ba(OH)2溶液aL与pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计),若所得混合溶液呈中性,则a∶b=_________。
【答案】 108 1×10-13 高于 10-4 1∶100
【解析】(1)常温下,将1mLpH=1的H2SO4溶液加水稀释到100mL,稀释后的pH=3,则溶液中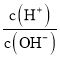 =10-3÷10-11=108。(2)某温度时,测得0.01mol·L-1的NaOH溶液的pH为11,其中氢氧根浓度是0.01mol/L,所以该温度下水的离子积常数Kw=10-11×0.01=1×10-13。水的电离吸热,所以该温度高于25℃。(3)硫酸抑制水的电离,常温下pH=5的H2SO4溶液中由水电离出的H+浓度为10-9mol/L;硫酸铝水解,促进水的电离,则pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为10-5mol/L,则
=10-3÷10-11=108。(2)某温度时,测得0.01mol·L-1的NaOH溶液的pH为11,其中氢氧根浓度是0.01mol/L,所以该温度下水的离子积常数Kw=10-11×0.01=1×10-13。水的电离吸热,所以该温度高于25℃。(3)硫酸抑制水的电离,常温下pH=5的H2SO4溶液中由水电离出的H+浓度为10-9mol/L;硫酸铝水解,促进水的电离,则pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为10-5mol/L,则![]() =1×10-4。(4)所得混合溶液呈中性,说明氢离子与氢氧根的物质的量相等,即aL×0.1mol/L=bL×0.001mol/L,则a∶b=1∶100。
=1×10-4。(4)所得混合溶液呈中性,说明氢离子与氢氧根的物质的量相等,即aL×0.1mol/L=bL×0.001mol/L,则a∶b=1∶100。

练习册系列答案
 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目