题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 硅晶体中,有NA个Si就有2 NA个Si—Si键
B. 常温常压下,等物质的量浓度的Na2CO3与Na2S溶液中Na+数目相等
C. 惰性电极电解食盐水,若线路中通过2 NA个电子的电量时,则阳极产生气体22.4 L
D. 标准状况下,2 mol Na2O2与44.8 L SO2完全反应,转移的电子数目为2 NA
【答案】A
【解析】A,硅晶体属于原子晶体,其中n(Si):n(Si-Si)=1:2,有NA个Si就有2NA个Si-Si键,A项正确;B,由于溶液的体积未知,无法判断两溶液中Na+的大小关系,B项错误;C,惰性电极电解食盐水时阳极电极反应式为2Cl--2e-=Cl2↑,线路中通过2NA个电子时生成1molCl2,但由于Cl2所处温度和压强未知,无法用22.4L/mol计算Cl2的体积,C项错误;D,n(SO2)=![]() =2mol,Na2O2与SO2反应的化学方程式为Na2O2+SO2=Na2SO4~2e-,2molNa2O2与2molSO2完全反应转移4mol电子,D项错误;答案选A。
=2mol,Na2O2与SO2反应的化学方程式为Na2O2+SO2=Na2SO4~2e-,2molNa2O2与2molSO2完全反应转移4mol电子,D项错误;答案选A。

 阅读快车系列答案
阅读快车系列答案【题目】Ⅰ.下表是元素周期表的一部分,根据表中列出的10种元素,回答下列问题。
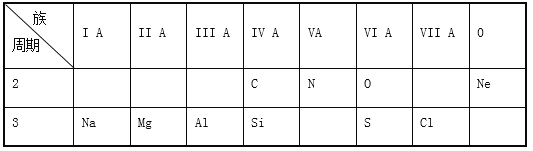
(1)O和S中,原子半径较大的是________;(填元素符号或化学,以下同)
(2)CH4和NH3中,热稳定性较强的是________;
(3)新制氯水有漂白作用,是因为其中含有________;
(4)元素最高价氧化物对应水化物中,两性氢氧化物是________________;
(5)上表元素中,存放最高价氧化物对应水化物的碱性最强的溶液的试剂瓶盖不能用玻璃塞,请写出该反应的离子方程式_______________。
Ⅱ.现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第3周期元素的简单离子中半径最小 |
(1)元素T在元素周期表中的位置是________________。
(2)元素Y与元素Z相比,金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是______(填序号)。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)上述四种元素中有2种元素能形成一种淡黄色的固体,该化合物的电子式是________________,所含化学键的类型有________________。


