题目内容
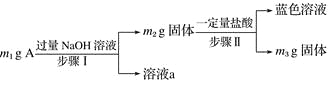
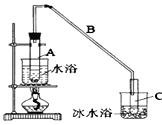
【题目】利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如图所示:
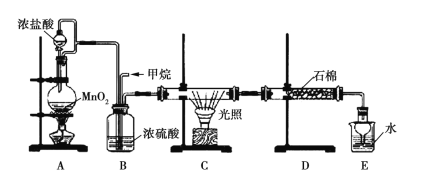
(1)A中制取Cl2的反应的化学方程式是_________________________。
(2)B装置的作用:①______;②______;③______。
(3)D装置中的石棉上吸附着潮湿的KI,其作用是________________。
(4)E装置的作用是_____(填序号)。
A.收集气体 B.吸收氯气 C.吸收氯化氢
(5)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是______________。
(6)将1 mol CH4与Cl2发生取代反应,测得4种有机取代产物的物质的量相等,则消耗的氯气的物质的量是_____。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 控制气流速度 使气体混合均匀 干燥气体 除去过量的Cl2 C 分液 2.5 mol
MnCl2+Cl2↑+2H2O 控制气流速度 使气体混合均匀 干燥气体 除去过量的Cl2 C 分液 2.5 mol
【解析】
甲烷与氯气在光照的条件下发生取代反应生成多种氯代甲烷和氯化氢。A装置是浓盐酸和二氧化锰制取氯气的发生装置,通过B装置,除去氯气中的水蒸气,控制两种气体的流速,使氯气和甲烷混合均匀,C装置是甲烷和氯气发生取代反应的装置,D装置盛有湿润的KI粉末可以用来除去过量的氯气,尾气中含有有毒气体CH3Cl和过量的甲烷,容易污染空气,需要进行尾气处理,据此判断。
(1)MnO2能与HCl(浓)发生氧化还原反应生成MnCl2、Cl2和水,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(2)制备的氯气中含有水蒸气,可用浓硫酸除去,B装置的作用是干燥气体、使气体混合均匀、通过观察气泡来控制气流速度。
(3)氯气能将碘化钾氧化为碘单质,湿润的KI可除去过量的氯气。
(4)由于上述过程中产生的HCl易导致大气污染,所以E的作用是吸收尾气,HCl极易溶于水易发生倒吸,所以E还可以防止倒吸,答案选C。
(5)E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,二氯甲烷、三氯甲烷和四氯化碳不溶于水,能分层,可通过分液分开。
(6)1 mol CH4生成等物质的量的4种取代产物,即0.25 mol CH3Cl、0.25 mol CH2Cl2、0.25 mol CHCl3、0.25 mol CCl4,则所需n(Cl2)=0.25 mol×1+0.25 mol×2+0.25 mol×3+0.25 mol×4=2.5 mol。

 寒假学与练系列答案
寒假学与练系列答案【题目】按要求回答下列问题:
(1)常温下向一定体积的0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是__________。
A 溶液中导电粒子的数目减少 B 醋酸的电离程度增大,c(H+)亦增大
C 溶液中c(CH3COO-)/[c(CH3COOH)c(OH-)]不变 D 溶液中c(CH3COO-)/c(H+)减小
(2)①常温下将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则V1:V2=_____________(溶液体积变化忽略不计)。
(3)常温下,浓度均为0.lmol/L的下列五种溶液的pH值如表所示:
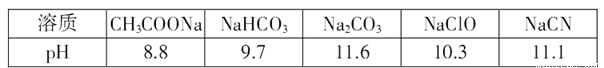
①根据表中数据,将浓度均为0.01 mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是_____
A HCN B HClO C H2CO3 D CH3COOH
②根据以上数据,判断下列反应可以成立的是________。
A CH3COOH+Na2CO3=NaHCO3+CH3COONa B CH3COOH+NaCN=HCN+CH3COONa
C CO2 +H2O+ 2NaClO=Na2CO3+2HClO D NaHCO3+HCN=NaCN+CO2 +H2O
(4)几种离子开始沉淀时的pH如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度离子Cu2+、Fe2+、Mg2+的溶液中滴加NaOH溶液时,_________(填离子符号)先沉淀。
(5)电解质水溶液中存在电离平衡、水解平衡,请回答下列问题。
(1)已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25 ℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①同浓度HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中碱性最强的是__________;
②体积相同、c(H+