题目内容
【题目】A由Al2O3、Fe3O4、Al、Cu中的某几种粉末混合而成,设计成分分析方案如下,下列分析不正确的是( )
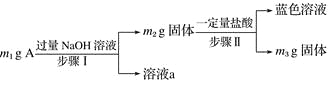
A. 当m1>m2时,溶液a中阴离子只有1种
B. 生成蓝色溶液的离子方程式涉Cu+2Fe3+===Cu2++2Fe2+
C. 要确定混合物中是否含Al,可取A加入适量稀HCl
D. 当m2-m3=2.96 g,Fe3O4的质量至少为2.32 g
【答案】A
【解析】试题分析:A、当m1>m2时,说明至少有Al2O3、Al两者中的一种,且生成了偏铝酸钠溶液,而过量的氢氧化钠,阴离子不至一种,故A错误;B、Fe3O4与盐酸反应生成氯化铁和氯化亚铁,三价铁离子有强氧化性,发生Cu+2Fe3+═Cu2++2Fe2+,故B正确;C、金属氧化物与酸反应生成水,无氢气,而铜与盐酸不反应在,可取A加入适量稀HCl,如果有气体产生,证明铝的存在,故C正确;D、因固体质量改变的金属氧化物的溶解,和三价铁与铜单质之间的氧化还原反应,Cu+2Fe3+=Cu2++2Fe2+,Fe3O4~2Fe3+~Cu,也就是四氧化三铁和铜的物质的量大于1:1,m2-m3=2.96g才符合,最小值为1:1,即2.96g×232÷(232+64)=2.32g,故D正确。

练习册系列答案
相关题目









