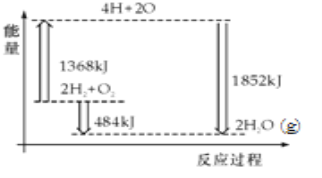
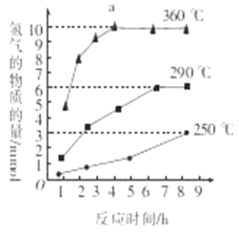
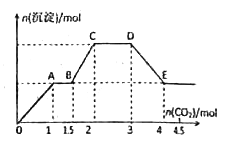
��Ŀ����
����Ŀ����֪Fe2O3��s��+3CO��g��2Fe��s��+3CO2��g���ڲ�ͬ�¶��µ�ƽ�ⳣ�������
�¶�/�� | 1000 | 1150 | 1300 |
ƽ�ⳣ�� | 42.9 | 50.7 | 64.0 |
��ش��������⣺
��1���÷�Ӧ��ƽ�ⳣ������ʽK= ______ ����H ______ 0����������������������=������
��2����һ���ݻ�Ϊ10L���ܱ������У�1300��ʱ����Fe��Fe2O3��CO��CO2��1mol����Ӧ����10min��ﵽƽ�⣮���ʱ�䷶Χ�ڷ�Ӧ��ƽ����Ӧ����v��CO2��= ______ ��CO��ƽ��ת����Ϊ ______��
��3������ߣ�2����CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� ______��
A������Fe2O3����B��������ʵĴ���C���Ƴ�����CO2D����߷�Ӧ�¶ȣ�
���𰸡� 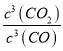 �� 0.006mol/��Lmin�� 60% CD
�� 0.006mol/��Lmin�� 60% CD
�������������������1������ƽ�ⳣ����������������¶Ⱥ�ƽ�ⳣ���Ĺ�ϵ���
��2������ƽ�ⳣ���������ʽ���㣻
��3���������������ƽ��״̬��Ӱ�������
��������1����ѧƽ�ⳣ������һ�������£������淴Ӧ�ﵽƽ��״̬ʱ��������Ũ�ȵ���֮���ͷ�Ӧ��Ũ�ȵ���֮���ı�ֵ����˸��ݷ���ʽ��֪�÷�Ӧ��ƽ�ⳣ������ʽ K��![]() �����ݱ������ݿ�֪�����¶�ƽ�ⳣ��������˵�������¶�ƽ��������Ӧ������У�������Ӧ�����ȷ�Ӧ������H��0��
�����ݱ������ݿ�֪�����¶�ƽ�ⳣ��������˵�������¶�ƽ��������Ӧ������У�������Ӧ�����ȷ�Ӧ������H��0��
��2�� Fe2O3(s)��3CO(g) ![]() 2Fe(s)��3CO2(g)
2Fe(s)��3CO2(g)
��ʼŨ�ȣ�mol/L�� 0.1 0.1
ת��Ũ�ȣ�mol/L�� x x
ƽ��Ũ�ȣ�mol/L�� 0.1-x 0.1+x
�����ƽ�ⳣ����֪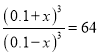 �����x��0.06�����ʱ�䷶Χ�ڷ�Ӧ��ƽ����Ӧ���� v(CO2)��0.06mol/L��10min��0.006mol/(L��min)��CO��ƽ��ת����Ϊ
�����x��0.06�����ʱ�䷶Χ�ڷ�Ӧ��ƽ����Ӧ���� v(CO2)��0.06mol/L��10min��0.006mol/(L��min)��CO��ƽ��ת����Ϊ![]() ��
��
��3��A�����ӹ���Fe2O3�������ܸı�ƽ��״̬��ת���ʲ��䣬A����B��������ʵĴ������ܸı�ƽ��״̬��ת���ʲ��䣬B����C���Ƴ�����CO2������������Ũ�ȣ�ƽ��������Ӧ������У�ת������ߣ�C��ȷ��D������Ӧ���ȣ���߷�Ӧ�¶ȣ�ƽ��������Ӧ������У�ת������ߣ�D��ȷ����ѡCD��