题目内容
【题目】现有易溶强电解质的混合溶液10L,其中可能含有K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如下明所示,下列说法正确的是
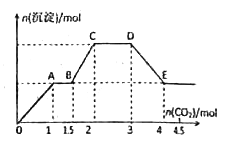
A. 该溶液中能确定存在的离子是Ba2+、AlO2-、NH4+
B. 肯定不存在的离子是SO42-、OH-
C. 若不能确定的离子中至少还存在着一种阳离子,则该离子的最小浓度为0.2 mol/L
D. OA段反应的离子方程式:2 AlO2-+ CO2+3H2O=2Al(OH)3↓+CO32-
【答案】C
【解析】试题分析:通入二氧化碳,在OA段产生沉淀,说明一定含Ba2+、OH-,根据离子共存条件,一定不含NH4+、SO42-,因反应会生成硫酸钡沉淀、一水合氨;在BC段产生沉淀,说明含AlO2-,根据OA段,通入1mol二氧化碳生成1mol沉淀,所以 Ba2+为1mol,反应方程式为:Ba(OH)2+CO2=BaCO3↓+H2O,AB段沉淀不变,说明二氧化碳和OH-反应,结合OA段可知含 OH-共3mol,根据BC段可知发生反应:2AlO2-+ CO2+3H2O=2Al(OH)3↓+CO32-,消耗二氧化碳0.5mol,即AlO2-的物质的量为1mol,CD段发生反应:CO32-+CO2+H2O═2HCO3-,DE段发生反应:BaCO3+CO2+H2O═Ba2++2HCO3-,根据电荷守恒,所含阳离子所带正电荷为Ba2+所带:2mol,阴离子所带负电荷为AlO2-、OH-所带:3mol+1mol=4mol,故一定还含阳离子。根据以上分析,一定含Ba2+、AlO2-、OH-,一定不含:NH4+、SO42-;氯离子不能确定,至少还存在一种阳离子存在,所给阳离子中还有K+、Na+没确定,根据电荷守恒,所含离子的物质的量设为n,则有:n+2mol=4mol,n=2,浓度为:2mol÷10L=0.2mol/L,若含氯离子,则阳离子浓度大于0.2mol/L;答案选C。

【题目】已知Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)在不同温度下的平衡常数如表:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 42.9 | 50.7 | 64.0 |
请回答下列问题:
(1)该反应的平衡常数表达式K= ______ ,△H ______ 0(填“>”、“<”或“=”)。
(2)在一个容积为10L的密闭容器中,1300℃时加入Fe、Fe2O3、CO、CO2各1mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)= ______ ,CO的平衡转化率为 ______。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 ______。
A.增加Fe2O3的量B.加入合适的催化剂C.移出部分CO2D.提高反应温度.
【题目】下列关于各物质的所属类别及性质的描述不正确的是
选项 | A | B | C | D |
物质 | 乙烯 | 氯化钠 | 氢氧化铁胶体 | 生铁 |
类别 | 烃 | 离子化合物 | 混合物 | 合金 |
性质 | 不可燃 | 熔融态能导电 | 能产生丁达尔现象 | 易发生电化学腐蚀 |
A.AB.BC.CD.D