题目内容
13.运用元素周期表分析下面的推断,其中正确是( )| A. | BeCl2为共价化合物 | |
| B. | At2为无色固体,HAt不稳定,AgAt感光性强,但不溶于水也不溶于稀酸 | |
| C. | 硫酸钡是难溶于水的白色固体 | |
| D. | 硒化氢是无色、有毒、比H2S稳定的气体 |
分析 A.铍和Al位于对角线位置,其氯化物性质相似;
B.同主族元素的单质及化合物性质相似;
C.第ⅡA族元素的硫酸盐从钙开始微溶至难溶;
D.同主族从上到下非金属性减弱.
解答 解:A.铍和Al位于对角线位置,其氯化物性质相似,氯化铝为共价化合物,则BeCl2为共价化合物,故A正确;
B.由同主族化合物性质相似可知,HAt不稳定,AgAt感光性强,但不溶于水也不溶于稀酸,但At为第六周期ⅦA族元素,卤族元素随电子层数的增多,单质的颜色不断加深,所以At2不可能是无色固体,故B错误;
C.锶是第五周期第ⅡA族元素,第ⅡA族元素的硫酸盐从钙开始微溶至难溶,硫酸钡是难溶于水的白色固体,故C正确;
D.硒是第四周期第VI A族元素,硒化氢的性质与H2S相似,但非金属性S强,没有H2S稳定,故D错误.
故选AC.
点评 本题考查元素周期律知识,为高频考点,把握元素在元素周期表中的位置和元素周期律性质的递变规律为解答的关键,注意将不熟悉的元素和熟悉的元素相比较,从而得出结论,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.最近有人用${\;}_{12}^{26}$Mg核轰击${\;}_{96}^{248}$Cm核,发生核合成反应得到新原子${\;}_{108}^{269}$Hs,该原子里中子数与核外电子数之差为( )
| A. | 53 | B. | 84 | C. | 108 | D. | 161 |
1.关于1mol•L-1的硫酸溶液的下列叙述中,不正确的是( )
| A. | 1L该溶液中含溶质98g | |
| B. | 从10mL 该溶液中取出5mL后,剩余溶液的浓度为0.5mol•L-1 | |
| C. | 将4.9g浓硫酸加入盛有50mL蒸馏水的烧杯中充分溶解就可配得该浓度的硫酸溶液 | |
| D. | 该浓度的硫酸具有酸的通性,但不具有强氧化性 |
18.能正确表示下列反应的离子方程式是( )
| A. | 足量硫化氢气体通入硫酸铁溶液中:H2S+Fe3+═Fe2++S↓+2H+ | |
| B. | 足量铁与稀硝酸反应:Fe+4H++NO3-═Fe2++4H2O+NO↑ | |
| C. | 醋酸溶液与纯碱反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 等物质的量的Ba(OH)2与NaHSO4在溶液中反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
5.将0.1mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时都会引起( )
| A. | CH3COOH电离程度变大 | B. | 溶液pH减小 | ||
| C. | 溶液的导电能力减弱 | D. | 溶液中c(H+)减小 |
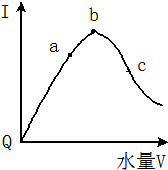 在室温下,冰醋酸加水稀释过程中,溶液导电能力I随加入水量(V表示体积)的变化曲线如图所示,请回答:
在室温下,冰醋酸加水稀释过程中,溶液导电能力I随加入水量(V表示体积)的变化曲线如图所示,请回答: