题目内容
8.BGO是我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验,它是锗酸铋的简称.已知:①在BGO中,锗处于其最高价态;②在BGO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中,铋具有最外层8电子稳定结构;③BGO可看做是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在BGO晶体的化学式中,这两种氧化物所含氧的总质量相同.请填空:(1)锗和铋的元素符号分别是Ge和Bi.
(2)BGO晶体的化学式是Bi4(GeO4)3[或Bi4Ge3O12或2Bi2O3•3GeO2].
(3)BGO晶体中所含铋氧化物的化学式是Bi2O3.
分析 (1)锗、铋两种元素都属于主族元素,元素符合遵循第一个字母大写,第二个字母小写的规律;
(2)元素锗属于ⅣA主族,因而最高化合价为+4价,铋为V A主族中的元素之一,其原子最外层有5个电子,元素最高价为+5价,但由信息②可知Br的化合价为+3价;
(3)晶体BGO的化学组成可写做mBi2O3•nGeO2.晶体中这两种化合物有相同质量的氧,那么,其化学式应为2Bi2O3•3GeO2,即Bi4Ge3O12.
解答 解:(1)锗和铋的元素符号分别为Ge,Bi,故答案为:Ge;Bi;
(2)因锗(Ge)元素为+4价,则其氧化物的化学式为GeO2,铋元素(Bi)的化合价表现为+3,则其氧化物的化学式为Bi2O3,由两种氧化物所含氧的质量相同,则BGO的化学式可写成:3GeO2•2Bi2O3,即化学式为Bi4Ge3O12,故答案为:Bi4(GeO4)3[或Bi4Ge3O12或2Bi2O3•3GeO2];
(3)由上述分析,因在BGO中铋呈+3价,所以氧化物为Bi2O3,故答案为:Bi2O3.
点评 本题考查元素元素周期表和元素周期律的应用,为高频考点,把握习题中信息BGO可看成由锗和铋两种元素的氧化物所形成的化合物是解答化学式的关键,侧重迁移应用能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.阿伏加德罗常数约为6.02×1023mol-1.下列叙述中正确的是( )
| A. | 标准状况下,2.24L苯中约含有3.612×1023个碳原子 | |
| B. | 常温常压下,氧气和臭氧的混合物16g中约含有6.02×1023个氧原子 | |
| C. | 1L 1mol/L醋酸溶液中离子总数为1.204×l024 | |
| D. | 0.5mol CH4中约含有3.01×1023个电子 |
16.用氯气消毒过的自来水配制下列溶液时,会使所配的溶液的溶质发生变化的是( )
①NaOH ②AgNO3 ③Na2CO3 ④NaBr ⑤KI.
①NaOH ②AgNO3 ③Na2CO3 ④NaBr ⑤KI.
| A. | 只有①② | B. | 只有①④⑤ | C. | 只有②④⑤ | D. | ①②③④⑤ |
3.下列关于丙烯(CH3-CH=CH2)的说法正确的( )
| A. | 丙烯分子有8个σ键,1个π键 | |
| B. | 丙烯分子中3个碳原子都是sp3杂化 | |
| C. | 丙烯分子存在非极性键 | |
| D. | 丙烯分子中3个碳原子在同一直线上 |
13.运用元素周期表分析下面的推断,其中正确是( )
| A. | BeCl2为共价化合物 | |
| B. | At2为无色固体,HAt不稳定,AgAt感光性强,但不溶于水也不溶于稀酸 | |
| C. | 硫酸钡是难溶于水的白色固体 | |
| D. | 硒化氢是无色、有毒、比H2S稳定的气体 |
18.在容积固定不变的密闭容器中加入1mol N2和3mol H2发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,下列结论正确的是( )
| A. | 该反应达到平衡时,放出的热量等于92.4KJ | |
| B. | 达到平衡后向容器中通入1mol氦气,平衡不移动 | |
| C. | 降低温度和缩小容器体积均可使该反应的平衡常数增大 | |
| D. | 若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的80% |
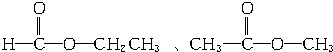 、
、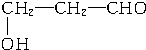 、
、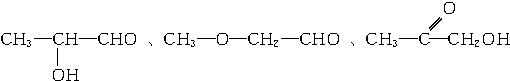 .
.