题目内容
18.能正确表示下列反应的离子方程式是( )| A. | 足量硫化氢气体通入硫酸铁溶液中:H2S+Fe3+═Fe2++S↓+2H+ | |
| B. | 足量铁与稀硝酸反应:Fe+4H++NO3-═Fe2++4H2O+NO↑ | |
| C. | 醋酸溶液与纯碱反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 等物质的量的Ba(OH)2与NaHSO4在溶液中反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
分析 A.电荷不守恒;
B.电荷不守恒;
C.醋酸为弱电解质,不能拆;
D.等物质的量的Ba(OH)2与NaHSO4在溶液中反应,生成硫酸钡、氢氧化钠和水.
解答 解:A.足量硫化氢气体通入硫酸铁溶液中反应的离子方程式为H2S+2Fe3+═2Fe2++S↓+2H+,故A错误;
B.足量铁与稀硝酸反应,离子方程式:3Fe+8H++2NO3-═3Fe2++4H2O+2NO↑,故B错误;
C.醋酸溶液与纯碱反应,离子方程式:CO32-+2CH3COOH═H2O+CO2↑+2CH3COO-,故C错误;
D.等物质的量的Ba(OH)2与NaHSO4在溶液中反应,生成硫酸钡、氢氧化钠和水,离子方程式:Ba2++OH-+H++SO42-═BaSO4↓+H2O,故D正确;
故选:D.
点评 本题考查离子反应方程式书写的正误判断,明确反应实质是解题关键,注意反应物用量对反应的影响,选项D为易错选项.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
9.已知:CH4(g)+2O2(g)═CO2(g)+2H2O(1)△H1=-Q1 KJ/mol
2H2(g)+O2(g)═2H2O(g)△H2=-Q2 KJ/mol
2H2(g)+O2(g)═2H2O(1)△H3=-Q3KJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则下列说法正确的是( )
2H2(g)+O2(g)═2H2O(g)△H2=-Q2 KJ/mol
2H2(g)+O2(g)═2H2O(1)△H3=-Q3KJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则下列说法正确的是( )
| A. | 放出的热量为(0.4Q1+0.1Q3)KJ | B. | 放出的热量为(0.4Q1+0.05Q2)KJ | ||
| C. | 放出的热量为(0.4Q1+0.05Q3)KJ | D. | △H2<△H3 |
13.运用元素周期表分析下面的推断,其中正确是( )
| A. | BeCl2为共价化合物 | |
| B. | At2为无色固体,HAt不稳定,AgAt感光性强,但不溶于水也不溶于稀酸 | |
| C. | 硫酸钡是难溶于水的白色固体 | |
| D. | 硒化氢是无色、有毒、比H2S稳定的气体 |
3.如图是恒温下某化学反应的反应速率随反应时间变化的示意图.下列叙述与示意图不相符合的是( )
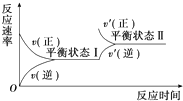

| A. | 反应达平衡时,正反应速率和逆反应速率相等 | |
| B. | 该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ | |
| C. | 该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ | |
| D. | 同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等 |
10.下列陈述中,Ⅰ、Ⅱ都正确且两者间具有因果关系的一组是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 明矾水解时产生具有吸附性的胶体粒子 | 明矾可作自来水消毒 |
| B | Fe3+有氧化性 | FeCl3溶液可用于溶解回收旧电路板 中的铜 |
| C | NH4Cl受热分解 | 加热可将Ca(OH)2和NH4Cl固体混合物分离 |
| D | SO2具有氧化性 | SO2可用于漂白纸浆 |
| A. | A | B. | B | C. | C | D. | D |
7.下表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:①N,⑤Si,⑦C.
(2)画出原子的结构示意图:④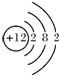 ,⑥
,⑥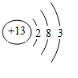 ,⑧
,⑧ .
.
(3)在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ar.
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应: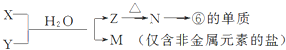
X溶液与Y溶液反应的离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$,
N→⑥的单质的化学方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑,
(6)在③与④中,化学性质较活泼的是Na,怎样用化学实验证明?
答:与水反应;
在⑧与⑫中,化学性质较活泼的是Cl2,请用化学方程式来说明.
答:Cl2+2NaBr=2NaCl+Br2.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ⑬ | |||||||
| 2 | ① | ⑭ | ② | |||||
| 3 | ③ | ④ | ⑥ | ⑤ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)画出原子的结构示意图:④
 ,⑥
,⑥ ,⑧
,⑧ .
.(3)在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ar.
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
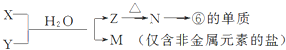
X溶液与Y溶液反应的离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$,
N→⑥的单质的化学方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑,
(6)在③与④中,化学性质较活泼的是Na,怎样用化学实验证明?
答:与水反应;
在⑧与⑫中,化学性质较活泼的是Cl2,请用化学方程式来说明.
答:Cl2+2NaBr=2NaCl+Br2.
8.下列实验可行的是( )
| A. | 用NaOH溶液除去CO2中混有的HCl气体 | |
| B. | 加入适量铜粉除去Cu(NO3)2溶液中的AgNO3杂质 | |
| C. | 所有不锈钢都只含有金属元素 | |
| D. | 用乙醇从碘水中萃取碘 |