题目内容
4.下列应用或事实与胶体的性质没有关系的是( )| A. | 工厂利用高压电除尘,有利于减轻雾霾和预防大气污染 | |
| B. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀 | |
| C. | 过滤泥水混合物,用激光笔照射滤液,能产生光亮的通路 | |
| D. | 江河入海出容易形成三角洲,如长江三角洲和黄河三角洲的形成 |
分析 A.胶体具有电泳的性质;
B.二者反应生成氢氧化铁沉淀;
C.胶体具有丁达尔效应;
D.依据胶体的聚沉的性质解答.
解答 解:A.胶体具有电泳的性质,在外加电源作用下,带电的胶体微粒能够发生定下移动,工厂利用高压电除尘,有利于减轻雾霾和预防大气污染就是利用胶体电泳的性质,故A不选;
B.在饱和氯化铁溶液中逐滴加入NaOH溶液,因为发生复分解反应产生红褐色沉淀,与胶体性质无关,故B选;
C.过滤泥水混合物,用激光笔照射滤液,能产生光亮的通路,属于胶体的丁达尔效应,故C不选;
D.江河入海出容易形成三角洲,如长江三角洲和黄河三角洲的形成,是因为发生了胶体的聚沉,与胶体聚沉有关,故D不选;
故选:B.
点评 本题考查了胶体的性质及应用,熟悉胶体的性质是解题关键,侧重考查学生对基础知识掌握熟练程度,题目难度不大.

练习册系列答案
相关题目
17. 硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐.
硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐.
其化学式为:FeSO4•(NH4)2SO4•6H2O 硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了.硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得.三种盐的溶解度(单位为g/100g水)如下表:
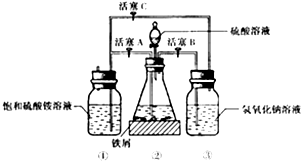
如图是模拟工业制备硫酸亚铁铵晶体的实验装置
回答下列问题:
Ⅰ.(1)先用30%的氢氧化钠溶液煮沸废铁屑(含少量油污、铁锈、FeS等),再用清水洗净,用氢氧化钠溶液煮沸的目的是除去铁屑中油污
(2)将处理好的铁屑放入锥形瓶中,加入稀硫酸,锥形瓶中发生反应的离子方程式可能为ABCD(填序号)
A.Fe+2H+═Fe2++H2↑ B.Fe2O3+6H+═2Fe3++3H2O
C.2Fe3++H2S═2Fe2++S↓+2H+ D.2Fe3++Fe═3Fe2+
(3)利用容器②的反应,向容器①中通入氢气,应关闭活塞A,打开活塞BC(填字母).容器③中NaOH溶液的作用是吸收硫化氢气体,防止污染空气;向容器①中通人氢气的目的是防止亚铁离子被氧气氧化
Ⅱ.待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵.硫酸亚铁与硫酸铵溶液混合就能得到硫酸亚铁铵晶体,其原因是硫酸亚铁铵的溶解度最小;从容器①中分离并得到纯净硫酸亚铁铵晶体的操作方法是过滤、用酒精洗涤、干燥
Ⅲ.制得的硫酸亚铁铵晶体中往往含有极少量的Fe3+,为测定晶体中Fe2+的含量,称取一份质量为20.0g的硫酸亚铁铵晶体样品,制成溶液.用0.5mo1/LKMnO4溶液滴定,当溶液中Fe2+全部被氧化,MnO?4被还原成Mn2+时,耗KMnO4溶液体积20.00mL.滴定时,将KMnO4溶液装在酸式(填酸式或碱式)滴定管中,判断反应到达滴定终点的现象为溶液刚出现紫红色,保持30s不变;晶体中FeSO4的质量分数为38%.
 硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐.
硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐.其化学式为:FeSO4•(NH4)2SO4•6H2O 硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了.硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得.三种盐的溶解度(单位为g/100g水)如下表:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| 摩尔盐 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
回答下列问题:
Ⅰ.(1)先用30%的氢氧化钠溶液煮沸废铁屑(含少量油污、铁锈、FeS等),再用清水洗净,用氢氧化钠溶液煮沸的目的是除去铁屑中油污
(2)将处理好的铁屑放入锥形瓶中,加入稀硫酸,锥形瓶中发生反应的离子方程式可能为ABCD(填序号)
A.Fe+2H+═Fe2++H2↑ B.Fe2O3+6H+═2Fe3++3H2O
C.2Fe3++H2S═2Fe2++S↓+2H+ D.2Fe3++Fe═3Fe2+
(3)利用容器②的反应,向容器①中通入氢气,应关闭活塞A,打开活塞BC(填字母).容器③中NaOH溶液的作用是吸收硫化氢气体,防止污染空气;向容器①中通人氢气的目的是防止亚铁离子被氧气氧化
Ⅱ.待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵.硫酸亚铁与硫酸铵溶液混合就能得到硫酸亚铁铵晶体,其原因是硫酸亚铁铵的溶解度最小;从容器①中分离并得到纯净硫酸亚铁铵晶体的操作方法是过滤、用酒精洗涤、干燥
Ⅲ.制得的硫酸亚铁铵晶体中往往含有极少量的Fe3+,为测定晶体中Fe2+的含量,称取一份质量为20.0g的硫酸亚铁铵晶体样品,制成溶液.用0.5mo1/LKMnO4溶液滴定,当溶液中Fe2+全部被氧化,MnO?4被还原成Mn2+时,耗KMnO4溶液体积20.00mL.滴定时,将KMnO4溶液装在酸式(填酸式或碱式)滴定管中,判断反应到达滴定终点的现象为溶液刚出现紫红色,保持30s不变;晶体中FeSO4的质量分数为38%.
12. 在某密闭容器中,可逆反应:A(g)+B(g)?C(g)符合图中(Ⅰ)所示关系,φ(C)表示C气体在混合气体中的体积分数.由此判断,对图象(Ⅱ)说法不正确的是( )
在某密闭容器中,可逆反应:A(g)+B(g)?C(g)符合图中(Ⅰ)所示关系,φ(C)表示C气体在混合气体中的体积分数.由此判断,对图象(Ⅱ)说法不正确的是( )
 在某密闭容器中,可逆反应:A(g)+B(g)?C(g)符合图中(Ⅰ)所示关系,φ(C)表示C气体在混合气体中的体积分数.由此判断,对图象(Ⅱ)说法不正确的是( )
在某密闭容器中,可逆反应:A(g)+B(g)?C(g)符合图中(Ⅰ)所示关系,φ(C)表示C气体在混合气体中的体积分数.由此判断,对图象(Ⅱ)说法不正确的是( )| A. | p3>p4,Y轴表示A的转化率 | |
| B. | p3>p4,Y轴表示B的质量分数 | |
| C. | p3>p4,Y轴表示B的转化率 | |
| D. | p3>p4,Y轴表示混合气体的平均相对分子质量 |
19.已知使36g焦炭发生不完全燃烧,所得气体中CO占$\frac{1}{3}$体积,CO2占$\frac{2}{3}$体积,已知:
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-Q1kJ/mol,
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-Q2kJ/mol
与这些焦炭完全燃烧相比较,损失的热量是中正确的是( )
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-Q1kJ/mol,
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-Q2kJ/mol
与这些焦炭完全燃烧相比较,损失的热量是中正确的是( )
| A. | $\frac{1}{2{Q}_{2}}$ kJ | B. | Q2kJ | C. | $\frac{1}{3({Q}_{1}+{Q}_{2})}$kJ | D. | $\frac{1}{3{Q}_{1}}$kJ |
16.下列反应中均可在溶液中进行,能用同一离子方程式表示的是( )
| A. | NaHCO3、Na2CO3分别与盐酸反应 | B. | NaOH、Cu(OH)2分别与硫酸反应 | ||
| C. | Ca(OH)2、CaCl2分别与Na2CO3反应 | D. | Ba(NO3)2、Ba(OH)2分别与稀硫酸反应 |
13.下列数量的各物质所含原子数按由大到小的顺序排列是( )
①0.45mol氨气 ②标准状况下33.6L氦气 ③4℃时7.5mL水 ④0.2mol磷酸钠(Na3PO4)
①0.45mol氨气 ②标准状况下33.6L氦气 ③4℃时7.5mL水 ④0.2mol磷酸钠(Na3PO4)
| A. | ①④②③ | B. | ②①④③ | C. | ②①③④ | D. | ①④③② |
14.下列图示实验操作中,正确的是( )
| A. |  | B. |  | C. |  | D. |  |