题目内容
25 ℃时,PbCl2固体在不同浓度盐酸中的溶解度如图。在制备PbCl2的实验中,洗涤PbCl2固体最好选用( )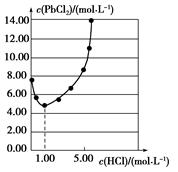
| A.蒸馏水 |
| B.1.00 mol·L-1盐酸 |
| C.5.00 mol·L-1盐酸 |
| D.10.00 mol·L-1盐酸 |
B
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
Na2S溶液中各种离子的物质的量浓度关系不正确的是( )
| A.c(Na+)>c(S2-)>c(OH-)>c(HS-) | B.c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-) |
| C.c(Na+)=2c(HS-)+2c(S2-)+2c(H2S) | D.c(OH-)=c(H+)+ c(HS-) |
下列说法正确的是
| A.pH=5的NH4 Cl溶液或醋酸中,由水电离出的c(H+)均为10-9 mol/L |
| B.常温时将pH=3的醋酸和pH=ll的NaOH溶液等体积混合后,pH >7 |
| C.在c(H+):c(OH-)=1:l012的溶液中,N a+、I-、NO3-、SO42-能大量共存 |
| D.0.1 mol/L Na2 CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中 |
常温下,用 0.1 mol·L—1HCl溶液滴定10.0 mL浓度为0.1 mol·L—1 Na2CO3溶液,所得滴定曲线如右图所示。下列说法正确的是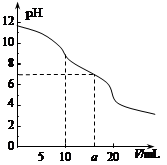
| A.当V=0时:c(H+)+c(HCO 3-)+c(H2CO3)=c(OH-) |
| B.当V=5时:c(CO32—)+c(HCO 3-)+c(H2CO3)=2c(Cl-) |
| C.当V=10时:c(Na+)>c(HCO 3-)>c(CO32—)>c(H2CO3) |
| D.当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-) |
已知在常温下测得浓度均为0.1 mol·L-1的下列三种溶液的pH:
| 溶质 | NaHCO3 | Na2CO3 | NaCN |
| pH | 9.7 | 11.6 | 11.1 |
下列说法中正确的是( )
A.阳离子的物质的量浓度之和:
Na2CO3>NaCN>NaHCO3
B.相同条件下的酸性:H2CO3<HCN
C.三种溶液中均存在电离平衡和水解平衡
D.升高Na2CO3溶液的温度,
 减小
减小 313 K时,水的KW=3.0×10-14,则在313 K时,c(H+)=10-7 mol/L的溶液( )
| A.呈酸性 | B.呈中性 | C.呈碱性 | D.无法判断 |
甲酸的下列性质中,可以证明它是弱电解质的是( )
| A.1 mol/L甲酸溶液的c(H+)=0.01 mol/L |
| B.甲酸能与水以任何比例互溶 |
| C.10 mL 1 mol/L甲酸恰好与10 mL 1 mol/L NaOH溶液完全反应 |
| D.甲酸溶液的导电性比盐酸的弱 |
下列关于电解质溶液的叙述正确的是( )
A.常温下,由0.1 mol·L-1一元碱BOH溶液的pH=10,可推知BOH溶液存在:BOH B++OH- B++OH- |
| B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) |
| C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低 |