题目内容
Na2S溶液中各种离子的物质的量浓度关系不正确的是( )
| A.c(Na+)>c(S2-)>c(OH-)>c(HS-) | B.c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-) |
| C.c(Na+)=2c(HS-)+2c(S2-)+2c(H2S) | D.c(OH-)=c(H+)+ c(HS-) |
D
解析试题分析:A、在Na2S溶液存在下列反应:Na2S=2Na++S2-;S2-+H2O HS-+OH-;HS-+H2O
HS-+OH-;HS-+H2O H2S+OH-;H2O
H2S+OH-;H2O H++OH-。但是盐水解的程度是微弱的,所以 c(Na+)>c(S2-)>c(OH-)>c(HS-)。正确。B、根据电荷守恒可得:c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)。正确。C、根据物料守恒可得:c(Na+)=2c(HS-)+2c(S2-)+2c(H2S)。正确。D、根据质子守恒可得:c(OH-)=c(H+)+ c(HS-)+2c(H2S).错误。
H++OH-。但是盐水解的程度是微弱的,所以 c(Na+)>c(S2-)>c(OH-)>c(HS-)。正确。B、根据电荷守恒可得:c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)。正确。C、根据物料守恒可得:c(Na+)=2c(HS-)+2c(S2-)+2c(H2S)。正确。D、根据质子守恒可得:c(OH-)=c(H+)+ c(HS-)+2c(H2S).错误。
考点:考查溶液中离子浓度的大小关系的知识。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列表达不正确的是
| A.NaHS在水中的电离方程式为:NaHS=Na++HS- 和HS- =H++S2- |
| B.同物质的量浓度的氨水和盐酸反应至中性时所用体积:V(NH3·H2O)<V(HCl) |
| C.Na2SO3溶液中:c(H+)+ c(HSO3-)+ 2c(H2SO3)= c(OH-) |
| D.同浓度的下列溶液中,c (CH3COO-)的大小:CH3COONa>CH3COONH4>CH3COOH |
常温下0.1 mol·L-1的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是
| A.c(H+) | B.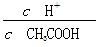 |
| C.c(H+)·c(OH-) | D.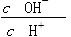 |
100℃时,水的离子积为1×10-12 mol2·L-2,若该温度下某溶液中的H+浓度为1×10-7 mol·L-1,则该溶液是( )
| A.酸性 | B.碱性 | C.中性 | D.无法判断 |
对水垢的主要成分是CaCO3和Mg(OH)2而不是CaCO3和MgCO3的解释,说法正确的是( )
| A.Mg(OH)2的溶度积大于MgCO3的溶度积,且在水中发生了沉淀转化 |
| B.Mg(OH)2比MgCO3更难溶,且在水中发生了沉淀转化 |
C.MgCO3电离出的CO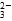 发生水解,使水中OH-浓度减小,对Mg(OH)2沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀 发生水解,使水中OH-浓度减小,对Mg(OH)2沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀 |
D.MgCO3电离出的CO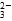 发生水解,促进水中OH-浓度增大,对Mg(OH)2沉淀溶解平衡而言,Qc>Ksp,生成Mg(OH)2沉淀 发生水解,促进水中OH-浓度增大,对Mg(OH)2沉淀溶解平衡而言,Qc>Ksp,生成Mg(OH)2沉淀 |
下列有关AgCl沉淀的溶解平衡的说法中,正确的是( )
| A.AgCl沉淀生成和溶解不断进行,但速率相等 |
| B.AgCl难溶于水,溶液中没有Ag+和Cl- |
| C.升高温度,AgCl的溶解度减小 |
| D.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度不变 |
在氯化铵溶液中,下列关系式正确的是( )
| A.c(Cl-)>c(N)>c(H+)>c(OH-) | B.c(N)>c(Cl-)>c(H+)>c(OH-) |
| C.c(Cl-)=c(N)>c(H+)=c(OH-) | D.c(N)=c(Cl-)>c(H+)>c(OH-) |
25 ℃时,PbCl2固体在不同浓度盐酸中的溶解度如图。在制备PbCl2的实验中,洗涤PbCl2固体最好选用( )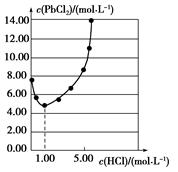
| A.蒸馏水 |
| B.1.00 mol·L-1盐酸 |
| C.5.00 mol·L-1盐酸 |
| D.10.00 mol·L-1盐酸 |