题目内容
25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol·L-1。下图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线。下列说法中,不正确的是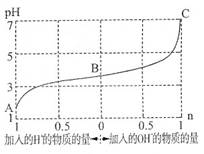
A.A、B、C三点所表示的溶液中水的电离程度依次增大
B.通入HCl,HA的电离常数减小,A-的水解程度增大
C.加入1 mol NaOH后,溶液中c(Na+)=c(A-)
D.未加HCl和NaOH时,溶液中c(A-)>c(Na+)>c(HA)
B
解析试题分析:A、A点H+浓度最大,对水的电离程度抑制作用最强,C点pH=7,对水的电离程度无抑制作用,所以A、B、C三点所表示的溶液中水的电离程度依次增大,正确;B、温度不变,HA的电离常数不变,错误;C、根据图像,加入1 mol NaOH后,溶液的pH=7,则c(H+)=c(OH?),根据电荷守恒可得c(H+)+c(Na+)=c(OH?)+c(A-),所以c(Na+)=c(A-),正确;D、未加HCl和NaOH时,溶质为HA和NaA,有图像可知pH<7,溶液显酸性,HA的电离程度大于NaA的水解程度,所以c(A-)>c(Na+)>c(HA),正确。
考点:本题考查弱电解质的电离、盐类的水解、离子浓度比较。

将氯化铝溶液蒸干并灼烧后得到纯净的固体A,将A在高温下熔融后用铂电极进行电解,下列有关电极产物的判断正确的是
| A.阴极产物是氢气 | B.阳极产物是氧气 |
| C.阴极产物是铝和氧气 | D.阳极产物只有氯气 |
已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如表,下列叙述正确的是
| 酸 | 电离平衡常数 |
| 醋酸 | K i=1.75×10-5 |
| 次氯酸 | K i=2.98×10-8 |
| 碳酸 | Ki1=4.30×10-7 Ki2=5.61×10-11 |
| 亚硫酸 | Ki1=1.54×10-2 Ki2=1.02×10-7 |
A.25℃,等PH值的CH3COONa、NaClO、Na2CO3和Na2SO3四种溶液中,物质的量最小的是Na2CO3
B.少量的SO2通入NaClO溶液中反应的离子方程式为:SO2 + H2O + 2ClO—
 SO32— + 2HClO
SO32— + 2HClOC.少量CO2通入Ca(ClO)2溶液中反应的离子方程式为:CO2 + H2O + ClO—
 HCO3— + HClO
HCO3— + HClOD.向pH=a的醋酸溶液中加一定量水,所得溶液的pH>a、pH<a、pH=a均有可能
25 ℃时,PbCl2固体在不同浓度盐酸中的溶解度如图。在制备PbCl2的实验中,洗涤PbCl2固体最好选用( )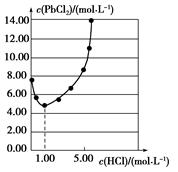
| A.蒸馏水 |
| B.1.00 mol·L-1盐酸 |
| C.5.00 mol·L-1盐酸 |
| D.10.00 mol·L-1盐酸 |
在0.1 mol·L-1的NH4HSO4溶液中,下列微粒的物质的量浓度关系不正确的是 ( )
| A.c(H+)>c(SO42-)>c(NH4+) |
| B.c(NH4+)+c(H+)=2c(SO42-)+c(OH-) |
| C.c(H+)=c(NH4+)+c(NH3·H2O)+c(OH-) |
| D.室温下滴加NaOH溶液至中性后:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
下列叙述正确的是 ( )
| A.一般认为沉淀离子浓度小于10-4 mol/L时,则认为已经沉淀完全 |
| B.反应AgCl+NaBr=AgBr+NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水 |
C.Al(OH)3(s) Al3+(aq)+3OH-(aq)表示沉淀溶解平衡,Al(OH)3 Al3+(aq)+3OH-(aq)表示沉淀溶解平衡,Al(OH)3 Al3++3OH-表示水解平衡 Al3++3OH-表示水解平衡 |
| D.只有反应速率很高的化学反应才能应用于工业生产 |
等物质的量浓度、等体积的下列溶液中:
①H2CO3、②Na2CO3、③NaHCO3、④NH4HCO3、⑤(NH4)2CO3,下列关系或者说法正确的是( )
| A.c(CO32—)的大小关系为:②>⑤>③>④>① |
| B.c(HCO3—)的大小关系为:④>③>⑤>②>① |
| C.将溶液蒸干灼烧后只有①不能得到对应的固体物质 |
| D.②③④⑤既能与盐酸反应,又能与NaOH溶液反应 |
在温度相同、浓度相同的条件下,下列六种物质的水溶液的pH由小到大的排列顺序如图所示。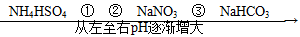
图中①②③可能是( )
| A.NH4NO3、(NH4)2SO4、CH3COONa |
| B.(NH4)2SO4、NH4Cl、C6H5ONa |
| C.(NH4)2SO4、NH4NO3、Na2CO3 |
| D.(NH4)2SO4、NH4NO3、CH3COONa |
50 ℃时,下列各溶液中,离子的物质的量浓度关系正确的是 ( )。
| A.pH=4的醋酸中:c(H+)=4.0 mol·L-1 |
| B.饱和小苏打溶液中:c(Na+)=c(HCO3—) |
| C.饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
| D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2 mol·L-1 |