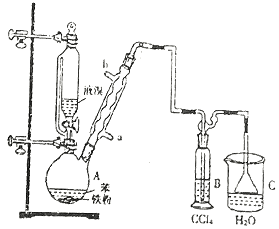
题目内容
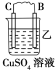
【题目】原电池由A、B、C、D四种金属按下表中装置图进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是________________________________。
(2)装置乙中正极的电极反应式是________________________________。
(3)装置丙中溶液的pH________(填“变大”“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是____________________________。
【答案】(1)A-2e-===A2+(2)Cu2++2e-=Cu(3)变大(4)D>A>B>C
【解析】
试题分析:(1)二价金属A不断溶解,说明A是负极,所以负极的电极反应式是A-2e-=A2+。
(2)乙装置中C的质量不断增加,说明C电极是正极,溶液中的铜离子放电生成铜,电极反应式是Cu2++2e-=Cu。
(3)丙装置中A电极上有气体生成,所以A电极是正极,溶液中的氢离子放电生成氢气,所以溶液的pH变大。
(4)甲中A是负极,B是正极;乙中C是正极,B是负极;丙中A是正极,D是负极,所以四种金属活泼性由强到弱的顺序是D>A>B>C。

【题目】Ⅰ.施莱辛(Schlesinger)等人提出可用NaBH4与水反应制取氢气:BH4- + 2H2O == BO2- + 4H2↑(反应实质为水电离出来的H+被还原)。研究表明,该反应生成H2的速率受外界条件影响,下表为pH和温度对NaBH4半衰期的影响(半衰期是指反应过程中,某物质的浓度降低到初始浓度一半时所需的时间)。
体系 pH | 不同温度下的半衰期(min) | |||
0℃ | 25℃ | 50℃ | 75℃ | |
8 | 4.32×100 | 6.19×10-1 | 8.64×10-2 | 1.22×10-2 |
10 | 4.32×102 | 6.19×101 | 8.64×100 | 1.22×100 |
12 | 4.32×104 | 6.19×103 | 8.64×102 | 1.22×102 |
14 | 4.32×106 | 6.19×105 | 8.64×104 | 1.22×104 |
(1)已知NaBH4与水反应后所得溶液显碱性,用离子方程式表示出溶液显碱性的原因 ,溶液中各离子浓度大小关系为 。
(2)从上表可知,温度对NaBH4与水反应速率产生怎样的影响? 。
(3)反应体系的pH为何会对NaBH4与水反应的反应速率产生影响? 。
Ⅱ.肼(N2H4)又称联氨,常温下是一种无色油状液体,沸点为113.5℃。肼和氧气在不同温度和催化剂条件下生成不同产物(如图)。

温度较低时主要反应①:N2H4 + O2 ![]() N2 + 2H2O
N2 + 2H2O
温度较高时主要反应②:N2H4 + 2O2 ![]() 2NO + 2H2O
2NO + 2H2O
不考虑其他反应,完成下列填空:
(4)若反应①在250℃时的平衡常数为K1,350℃时的平衡常数为K2,则K1 K2(填“>”、“<”或“=”)。
(5)反应于1100℃时达到平衡后,下列措施能使容器中![]() 增大的有 (填字母序号)。
增大的有 (填字母序号)。
A.恒容条件下,充入He气
B.增大容器体积
C.恒容条件下,充入N2H4
D.使用催化剂
(6)若将n mol肼和2n molO2充入某容积为n L的刚性容器中,在800℃和一定压强、合适催化剂的作用下,反应①和②同时达到平衡,实验测得N2的产率x,NO的产率为y,则该条件下反应②的平衡常数K= (用x、y的代数式表示,不必化简)。