题目内容
8.有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数,B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等; B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7:8,E与B的质量比为1:1.根据以上条件,回答下列问题:(1)推断五种元素分别是(用元素符号回答):CN,DSi,ES.
(2)写出D原子的电子排布式1s22s22p63s23p2.
(3)指出E元素在元素周期表中的位置第三周期ⅥA族.
(4)比较A、B、C三种元素的第一电离能的大小顺序N>O>C(按由大到小的顺序排列,用元素符号表示).
(5)比较元素D和E的电负性的相对大小Si<S.
分析 A原子最外层p能级的电子数等于次外层的电子数总数,p能级电子数不超过6,则A的核外电子排布为1s22s22p2,故A为碳元素;A、B、C属于同一周期,即位于第二周期,B原子最外层中有两个不成对的电子,核外电子排布式为1s22s22p4,故B为O元素,B元素可分别与A、C、D、E生成RB2型化合物,则C为N元素,可形成NO2化合物;在DB2中D与B的质量比为7:8,则有M(D):2M(O)=7:8,则M(D)=28,故D为Si元素;在EB2中E与B的质量比为1:1,则M(E)=2M(O)=2×16=32,所以E为S元素,据此解答.
解答 解:A原子最外层p能级的电子数等于次外层的电子数总数,p能级电子数不超过6,则A的核外电子排布为1s22s22p2,故A为碳元素;A、B、C属于同一周期,即位于第二周期,B原子最外层中有两个不成对的电子,核外电子排布式为1s22s22p4,故B为O元素,B元素可分别与A、C、D、E生成RB2型化合物,则C为N元素,可形成NO2化合物;在DB2中D与B的质量比为7:8,则有M(D):2M(O)=7:8,则M(D)=28,故D为Si元素;在EB2中E与B的质量比为1:1,则M(E)=2M(O)=2×16=32,所以E为S元素.
(1)由上述分析可知,C为N元素、D为Si、E为S,故答案为:N;Si;S;
(2)D为Si元素,原子序数为14,基态原子的核外电子排布式为1s22s22p63s23p2,故答案为:1s22s22p63s23p2;
(3)E为S元素,处于周期表中第三周期ⅥA族,故答案为:第三周期ⅥA族;
(4)同周期随原子序数增大,元素第一电离能呈增大趋势,由于N原子2p轨道为半充满状态,能量较大,第一电离能高于同周期相邻元素,故第一电离能N>O>C,故答案为:N>O>C;
(5)同周期随原子序数增大,越大电负性增大,故电负性Si<S,故答案为:Si<S.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、电负性等,推断元素是解题关键,注意理解掌握同周期第一电离能异常原因.

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案| A. | 冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物 | |
| B. | HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 | |
| C. | 漂白粉、福尔马林、冰水、王水、氯水均为混合物 | |
| D. | Na2O,NaOH,Na2CO3,NaCl,Na2SO4,Na2O2都属于钠的含氧化合物 |
| A. | 若a=b,则混合后溶液中一定有:c(X-)=c(Y+)>c(H+)=c(OH-) | |
| B. | 若m+n=14,则混合后溶液一定显中性 | |
| C. | 若混合后溶液中c(X-)<c(Y+),则该混合溶液一定显碱性 | |
| D. | 若a=b,混合后溶液pH<7,则混合溶液中一定存在:c(Y-)=c(X-)+c(HX) |
| A. | C2H4、C2H2 | B. | CH4、C2H6 | C. | CH4、C2H4 | D. | C2H2、C3H6 |
| A. | 相同浓度的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,铵根浓度大小关系为(NH4)2Fe(SO4)2>(NH4)2SO4>NH4Cl | |
| B. | 向AgCl悬浊液中滴入KI溶液有AgI沉淀生成,说明AgCl的溶解度小于AgI的溶解度 | |
| C. | 0.2 mol/L HCl溶液与等体积0.05 mol/L Ba(OH)2 溶液混合后,溶液的pH=1 | |
| D. | 0.2 mol/L的NaHCO3溶液中c(H+)+c(Na+)═c(CO32-)+c(OH-)+c(HCO3-) |
| A. | H+、K+、SO42-、Cl- | B. | OH-、Na+、Cu2+、SO42- | ||
| C. | ClO-、K+、Na+、Cl- | D. | Ag+、NO3-、Br-、NH4+ |
| A. | 丙烷具有同分异构体 | |
| B. | C2H4是最简单的烯烃 | |
| C. | CH2Cl2的结构有2种说明CH4是正四面体分子 | |
| D. | 因为乙烷不具有同分异构现象,所以二氯乙烷也不具有同分异构现象 |
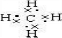 ,空间构型是正四面体,丙烷的结构简式为:CH3CH2CH3异丁烷的结构简式CH3CH(CH3)CH3
,空间构型是正四面体,丙烷的结构简式为:CH3CH2CH3异丁烷的结构简式CH3CH(CH3)CH3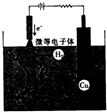 氧化亚铜(Cu2O)作为一种重要的无机化工原料,在涂料、有色玻璃和催化剂等领域有着广泛的用途.回答下列问题:
氧化亚铜(Cu2O)作为一种重要的无机化工原料,在涂料、有色玻璃和催化剂等领域有着广泛的用途.回答下列问题: